
����Ŀ��(1)��һ�ܱ�������ʢ��aLCl2��H2�Ļ�����壬�õ����ȼ�ָ���ԭ��״̬������������ΪaL����������NaOH��Һ����ȼ�պ�����壬���������ʣ�ࡣ��������������֪ԭ���������Cl2��H2���ʵ���֮��һ����_____��
A.Cl2��H2=1 B.Cl2��H2<1 C.Cl2��H2��1 D.Cl2��H2��1
(2)�����������г��ȼ�գ������ߵ������Ϊ1��2�����û������200mL 3.00mol/L��NaOH��Һ(�ܶ�Ϊ1.12g/mL)ǡ����ȫ���ա�
����ԭNaOH��Һ����������_______________���������С����ʾ������3λС����
����������Һ��Cl����ClO�������ʵ���֮��__________________��
������Һ��ClO�������ʵ���_____________��
���𰸡�C 10.7% 0.6mol 0.15mol
��������
(1)��������NaOH��Һ����ȼ�պ�����壬���������ʣ�࣬�����������һ������������������Դ������
(2)�ٸ���m=�ѡ�V������Һ������������m=n��M=c��V��M�������ʵ��������ٸ�������������ʽ���м��㣻
���������������ɵ��Ȼ�����������Ʒ�Ӧ�����Ȼ��ƣ��������������Ʒ�Ӧ�����Ȼ��ƺʹ������ƣ�����ԭ���غ������Һ��Cl-��ClO-�����ʵ���֮�ͣ�
�۸���ʣ������������ʵ����������������ӵ����ʵ�����
(1)��Cl2+H2![]() 2HCl����Ӧǰ��������䣬��������NaOH��Һ����ȼ�պ�����壬���������ʣ�࣬��������Ӧ����������Ӧ�������������һ�������������������Cl2��H2��1���ʺ���ѡ����C��
2HCl����Ӧǰ��������䣬��������NaOH��Һ����ȼ�պ�����壬���������ʣ�࣬��������Ӧ����������Ӧ�������������һ�������������������Cl2��H2��1���ʺ���ѡ����C��
(2)����Һ������m=�ѡ�V=1.12g/mL��200mL=224g�����ʵ�����m=n��M=c��V��M=3.00mol/L��0.2L��40g/mol=24g�����Ը���Һ�����ʵ���������![]() ��100%=10.7%��
��100%=10.7%��
���������������ɵ��Ȼ�����Ժ��������Ʒ�Ӧ�����Ȼ��ƣ��������������Ʒ�Ӧ�����Ȼ��ƺʹ������ƣ���Ӧ����ʽΪNaOH+HCl=NaCl+H2O��2NaOH+Cl2=NaCl+NaClO+H2O֪������Ԫ���غ��֪n(Cl2)=![]() n(NaOH)=
n(NaOH)=![]() ��3.00mol/L��0.2L=0.3mol���ٸ���ԭ���غ�֪��������Һ��Cl����ClO�������ʵ���֮��Ϊ2 n(Cl2)=0.6mol��
��3.00mol/L��0.2L=0.3mol���ٸ���ԭ���غ�֪��������Һ��Cl����ClO�������ʵ���֮��Ϊ2 n(Cl2)=0.6mol��
�۸���H2+Cl2![]() 2HCl��NaOH+HCl=NaCl+H2O��2NaOH+Cl2=NaCl+NaClO+H2O��֪����һ���Cl2��NaOH��Ӧ����NaCl��NaClO��Cl2��NaOH��Ӧ����һ���Cl2����NaClO������һ����
2HCl��NaOH+HCl=NaCl+H2O��2NaOH+Cl2=NaCl+NaClO+H2O��֪����һ���Cl2��NaOH��Ӧ����NaCl��NaClO��Cl2��NaOH��Ӧ����һ���Cl2����NaClO������һ����![]() ��Cl2����NaClO������Һ��ClO�������ʵ���n(ClO��)=
��Cl2����NaClO������Һ��ClO�������ʵ���n(ClO��)=![]() n(Cl2)=0.15mol��
n(Cl2)=0.15mol��


 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���׳�±ɰ����Ҫ���ڸɵ�ء����ʵȡ�ij��ѧ�о�С���������ʵ���Ʊ�±ɰ������Ԫ�زⶨ��
I��ʵ������NH3��HCl������A���Ʊ�±ɰ������װ�����¡�
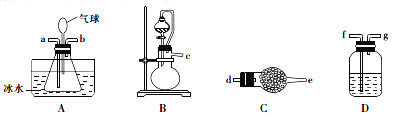
��1��װ�ýӿ�����˳����____________��a�� ___________��b����װ�ÿ��ظ�ѡ�ã�
��2��Cװ�õ�������__________________��Dװ��ʢװ��������__________________��
��3��д��������װ���Ʊ�������һ���Լ���_____________________��
II���ⶨ±ɰ��ClԪ�غ�NԪ�ص�����֮�ȡ�
���о�С��ȷ��ȡag±ɰ������������ͭ��ϼ��ȣ���ַ�Ӧ���������ﰴ��ͼװ�ý���ʵ�顣�ռ�װ���ռ���������Ϊ�����к����������壬���������ɱ�״���µ����ΪVL����ʯ������bg��
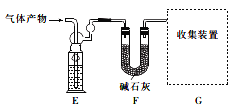
��4��Eװ���ڵ��Լ�Ϊ__________��±ɰ������ͭ��ϼ��ȷ�Ӧ�Ļ�ѧ����ʽΪ_______________��
��5��±ɰ��ClԪ�غ�NԪ�ص�����֮��Ϊ__________________���ú�b��v��ʽ�ӱ�ʾ����
��6��Ϊ�˲ⶨ±ɰ����Ԫ�ص�������������Ƶ�ʵ�鷽���ǽ�ag±ɰ��ȫ�ܽ���ˮ���������AgNO3��Һ��Ȼ��ⶨ���ɳ������������������۸÷����Ƿ��������˵������_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ȼ���ͭ�㷺Ӧ�����л��ϳɡ�ʯ�͡���֬��Ⱦ�ϵȹ�ҵ����ij��ͭ���(��Cu2S��CuS��FeS��)Ϊԭ����ȡCuCl�Ĺ�������������
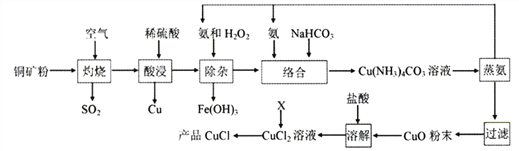
��֪����CuS��Cu2S��FeS���չ������ΪCu2O��FeO��
��Ksp(CuCl)=2��10-7��2Cu+=Cu+Cu2+��ƽ�ⳣ��K1=1��106
�ش�����������
��1����������ʱ������ԭ��Ԫ����____________(��Ԫ�ط���)��
��2�������������H2SO4���õ������98%H2SO4��ˮ��϶��ɡ�ʵ�������Ƹ�������Һ����IJ�������������������ͷ�ι���������_______���������ʱ����˹����ԭ����__________________��
��3�������������ܷ�Ӧ����ʽ��_____________________��
��4�����������Ӧ�е�NH3��NaHCO3���۱�ֵ��____________________��
��5���������������ڼ�ѹ�����½��е�ԭ����________________��
��6��X���Գ�����������еIJ�������X��SO2ʱ��ͨ��CuCl2��Һ�з�Ӧ�����ӷ���ʽ��________________����X��Cuʱ����ӦCu+Cu2++2Cl-=2CuCl��ƽ�ⳣ��K2=_________��
��7����ͭΪ�������NaCl��ҺҲ�ɵõ�CuCl��д�������缫��Ӧʽ__________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ����100mL0.100molL��1Na2CO3��Һ�ļ����ؼ�ʵ�鲽��Ͳ�������ͼ�ش��������⣺

��1��������ƿ����һ�����ʵ���Ũ�ȵ���Һ��������ƿ������_____��
������� ��ƿ����©ˮ�� ���������Ƶ���Һ��ϴ���� �������������Ҫ���
��2������Na2CO310H2O��������Һ����Ҫ��������_____�ˡ�������ȡ�ľ����Ѿ���һ����ʧȥ�˽ᾧˮ���������Ƶ���ҺŨ��ƫ_____�������/С����
��3��д��������Һ������Ҫ�õ��IJ������������ƣ��ձ���_____��
��4������Bͨ����Ϊת�ƣ�����Aͨ����Ϊ_____������D��Ϊ_____����û�в���D�������Ƶ�Ũ��ƫ_____�������/С������
��5��������ʵ�鲽��A��F��ʵ������Ⱥ��������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڱ�״����CH4��H2S��NH3��Ϊ���壬�ֱ�����11.2L H2S��16g CH4��1.204��1024��NH3���ӣ�������������С�Ƚ���ȷ���ǣ� ��
A. ���������������
B. �ܶȣ�����������
C. ����������������
D. ԭ������������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ȩ(HCHO)����ɫ���壬������ˮ��������Ĵ���ζ�������ۡ��ǵ��д̼����á�40%��ȩ��Һ�е�Ϊ96�棬�ӷ�����ȩ�ڼ�����Һ�о��м�ǿ�Ļ�ԭ�ԡ�Ϊ̽��������ȩ������Cu(OH)2��Ӧ�IJ���ɷ֣����������о���
��1������ͼװ���н���ʵ�飬��a�м���0.5mol��L-1CuSO4��Һ50mL��5 mol��L-1 NaOH��Һ100mL�����ټ���40%�ļ�ȩ��Һ40mL����������a����65��ʱ����20���Ӻ���ȴ�����¡���Ӧ�����й۲쵽����ɫ�������ɣ�����ɺ�ɫ���������������

������b��������____________��
������c������Ϊ____________��
����˵����ȩ���л�ԭ�Ե�ʵ��������____________��
��2���������Ϸ�����������Ǹ���Ӧ�����ġ�Ϊȷ����������к�H2����CO����װ��A������ͼ��ʾ��װ�����Ӻ����ʵ�顣

���������ӵĺ���˳��Ϊ��A��B��_____��_____��_____��_____��G��________
��װ��B��������_______________��
��ȷ����������к�H2������CO��������_________________________��
��3����֪��![]() ��֤��a�м�ȩ��̼Ԫ��δ��������+4�۵�ʵ�鷽��Ϊ��ȡ����a�з�Ӧ�����Һ��____________________����˵����ȩ��̼Ԫ��δ��������+4�ۡ�
��֤��a�м�ȩ��̼Ԫ��δ��������+4�۵�ʵ�鷽��Ϊ��ȡ����a�з�Ӧ�����Һ��____________________����˵����ȩ��̼Ԫ��δ��������+4�ۡ�
��4��Ϊ�о���ɫ����������ɣ���������ʵ��(����ÿ������ַ�Ӧ)��

��֪����.Cu2O ![]() [Cu(NH3)4]+(��ɫ)
[Cu(NH3)4]+(��ɫ) ![]() [Cu(NH3)4]2+(��ɫ)
[Cu(NH3)4]2+(��ɫ)
��.2Cu+8NH3��H2O+O2=2[Cu(NH3)4]2++4OH-+6H2O
ͨ������ʵ�飬���Եó���ɫ���������Ҫ��_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��G(���ǻ�������)�Ǻϳ�ij���Ƹ�Ѫѹҩ����м��塣һ���ɷ�����A�Ʊ�G�ĺϳ�·������ͼ��ʾ��

��ش��������⣺
(1)A������Ϊ___________��
(2)�Լ�M��___________��B��C�ķ�Ӧ������___________��
(3)E�Ľṹ��ʽΪ___________��F�к��й����ŵ�������___________��
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��___________��
(5)H��G��ͬ���칹�壬��������������������FeCl3��Һ������ɫ��Ӧ���ں˴Ź���������5��壬�����֮��Ϊ1�U2�U2�U2�U1����д��3������������H�Ľṹ��ʽ��___________��
(6)�����������Ⱦ�����塢���ϼ����ܼ��ȵ��������ο���Ŀ�е��й���Ϣ������ɱ��Ʊ�������ĺϳ�·��(���Լ���ѡ)��___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C�����ֶ���������Ԫ�ء�����һ�ֳ������������壬A��B��Cԭ������֮��Ϊ26������֮�������ͼ��ʾ��ϵ������˵����ȷ����

A. ����̬�⻯����ȶ���:C > B
B. ԭ�Ӱ뾶��С: C > B > A
C. �����ͬԪ�ص���һ������ֻ���Ǽ��Լ�
D. ��ҵ�ϳ��õ����������������ȡA�ĵ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��(NH4)2CO3(s)�TNH4HCO3(s)+NH3(g) ��H=+74.9kJ��mol��1������˵������ȷ����
A. �÷�Ӧ�����ȷ�Ӧ�����һ�������Է�����
B. �÷�Ӧ����������һ�������Է�����
C. �÷�Ӧ����S>0�����Ը��¿����Է�����
D. �Է����еķ�Ӧ�����Ƿ��ȷ�Ӧ�������Է����еķ�Ӧ�������ȷ�Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com