
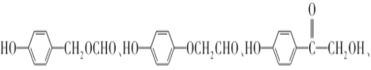
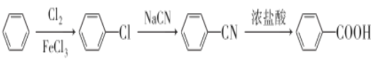
����Ŀ��G(���ǻ�������)�Ǻϳ�ij���Ƹ�Ѫѹҩ����м��塣һ���ɷ�����A�Ʊ�G�ĺϳ�·������ͼ��ʾ��

��ش��������⣺
(1)A������Ϊ___________��
(2)�Լ�M��___________��B��C�ķ�Ӧ������___________��
(3)E�Ľṹ��ʽΪ___________��F�к��й����ŵ�������___________��
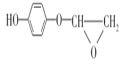
(4)д��D��E��Ӧ�Ļ�ѧ����ʽ��___________��
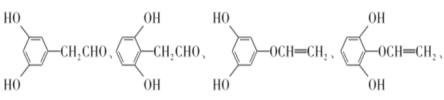
(5)H��G��ͬ���칹�壬��������������������FeCl3��Һ������ɫ��Ӧ���ں˴Ź���������5��壬�����֮��Ϊ1�U2�U2�U2�U1����д��3������������H�Ľṹ��ʽ��___________��
(6)�����������Ⱦ�����塢���ϼ����ܼ��ȵ��������ο���Ŀ�е��й���Ϣ������ɱ��Ʊ�������ĺϳ�·��(���Լ���ѡ)��___________��
���𰸡��ױ� Ũ���ᡢŨ���� ȡ����Ӧ����������Ӧ��  �Ȼ�������
�Ȼ������� ![]()
��������
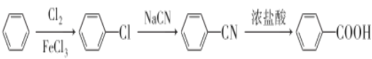
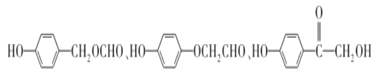
AΪ��������A��Cl2�����·��������ϵ�ȡ����Ӧ����B��B�ķ���ʽΪC7H7Cl����AΪ�ױ���A�Ľṹ��ʽΪ ![]() ���Ա�B��C�ķ���ʽ��B����CΪ������Ӧ���Ա�C��D�ķ���ʽ��Cת��ΪDΪ-Cl��-CNȡ����Dת��ΪE���������֪�ٵķ�Ӧ��D��-CNˮ���-COOH��Eת��ΪF���������֪�ڵķ�Ӧ��E��-NO2����ԭΪ-NH2��F��NaNO2 ��H2SO4��������G��G�Ľṹ��ʽΪ
���Ա�B��C�ķ���ʽ��B����CΪ������Ӧ���Ա�C��D�ķ���ʽ��Cת��ΪDΪ-Cl��-CNȡ����Dת��ΪE���������֪�ٵķ�Ӧ��D��-CNˮ���-COOH��Eת��ΪF���������֪�ڵķ�Ӧ��E��-NO2����ԭΪ-NH2��F��NaNO2 ��H2SO4��������G��G�Ľṹ��ʽΪ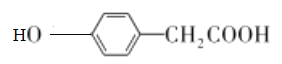 ��G������ȡ�������ڶ�λ�����Ƴ�C��D��E��F�е�����ȡ���������ڶ�λ��C�Ľṹ��ʽΪ
��G������ȡ�������ڶ�λ�����Ƴ�C��D��E��F�е�����ȡ���������ڶ�λ��C�Ľṹ��ʽΪ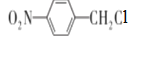 ��D�Ľṹ��ʽΪ
��D�Ľṹ��ʽΪ![]() ��E�Ľṹ��ʽΪ
��E�Ľṹ��ʽΪ ��F�Ľṹ��ʽΪ
��F�Ľṹ��ʽΪ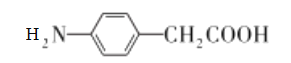 ��
��
��1��AΪ��������A��Cl2�����·��������ϵ�ȡ����Ӧ����B��B�ķ���ʽΪC7H7Cl����AΪ�ױ����ʴ�Ϊ���ױ���
��2��B��CΪ������Ӧ����Ӧ���Լ���Ũ���ᡢŨ���ᣬ�ʴ�Ϊ��Ũ���ᡢŨ���� ��ȡ����Ӧ����������Ӧ����
��3��E�Ľṹ��ʽΪ ��F�Ľṹ��ʽΪ��
��F�Ľṹ��ʽΪ��
 �����й��������Ȼ����������ʴ�Ϊ��
�����й��������Ȼ����������ʴ�Ϊ��
 ���Ȼ���������
���Ȼ���������
��4��D��E��Ӧ�Ļ�ѧ����ʽΪ��
![]() ���ʴ�Ϊ��
���ʴ�Ϊ��
![]() ��
��
��5��G�ķ���ʽΪC8H8O3��H��G��ͬ���칹�壬��������������������FeCl3��Һ������ɫ��Ӧ��˵�������ǻ��ں˴Ź���������5��壬�����֮��Ϊ1�U2�U2�U2�U1��˵����5�ֲ�ͬ������Hԭ�ӣ��ʷ���������H�У�
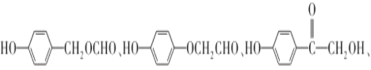
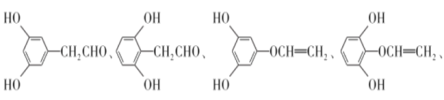
 ��
��
�ʴ�Ϊ��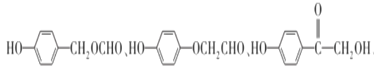 ��
��
 ��
��
��6������������Ϣ���ɱ��Ʊ�������ĺϳ�·��Ϊ��
 ���ʴ�Ϊ��
���ʴ�Ϊ��
 ��
��


 ����һ������ܼƻ�ϵ�д�
����һ������ܼƻ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��ڻ�ѧ������������ȷ����(����)
A.���й��ۼ��Ļ�����һ���ǹ��ۻ�����
B.���ʷ����о������ڻ�ѧ��
C.���ӻ�������һ���������Ӽ�
D.�ǽ���Ԫ���γɵĻ�����һ���ǹ��ۻ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ù�ҵ��Ǧ������п��(��Ҫ�ɷ�ΪZnO��PbO��FeO��MnO2��CuO)�ɻ����Ʊ�ZnCl2�������������£�

�ش���������
(1)����ȡ��ʵ���У���Ӧ��ϵ���¶ȡ���Ӧʱ������ѳ�Ч����Ӱ�����±������ʺϵ��¶Ⱥͷ�Ӧʱ��ֱ���________��________��
��1���¶ȶ����ѳ�Ч����Ӱ��
�¶�/�� | ��(Mn2+)/mg/L | ������/% |
10 | 0.325 | 87.9 |
30 | 0.341 | 89.5 |
50 | 0.424 | 84.3 |
70 | 0.646 | 76.1 |
��2����Ӧʱ������ѳ�Ч����Ӱ��
ʱ��/h | ��(Mn2+)/mg/L | ������/% |
1.0 | 0.995 | 63.1 |
1.5 | 0.794 | 70.6 |
2.0 | 0.328 | 87.9 |
2.5 | 0.325 | 87.9 |
(2)������1������Ҫ�ɷ���________��
(3)H2O2��Һ��������___________����֪������2������Ҫ�ɷ���Fe(OH)3��������п��������____________�����û���ʵ���з�����Ӧ�����ӷ���ʽ��Zn+Pb2+=Pb+Zn2+��_________��
(4)��п����ȡ����п�ɲ��ü��ܽ⣬Ȼ�����ȡҺ����֪��ZnO����NaOH��Һ������[Zn(OH)4]2���������ĵ缫��ӦΪ____________________________________________��
(5)ZnCl2�����ܽ��ڱ���Na2CO3��Һ�У��õ�6.46 g�ļ�ʽ̼��п[Znx(CO3)y(OH)z]��Ϊ�˲ⶨ����ɣ���ּ��ȷֽ⣬��������������ͨ��Ũ����ͼ�ʯ�ң������ֱ�������0.72g��0.88g����ü�ʽ̼��п�Ļ�ѧʽΪ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)��һ�ܱ�������ʢ��aLCl2��H2�Ļ�����壬�õ����ȼ�ָ���ԭ��״̬������������ΪaL����������NaOH��Һ����ȼ�պ�����壬���������ʣ�ࡣ��������������֪ԭ���������Cl2��H2���ʵ���֮��һ����_____��
A.Cl2��H2=1 B.Cl2��H2<1 C.Cl2��H2��1 D.Cl2��H2��1
(2)�����������г��ȼ�գ������ߵ������Ϊ1��2�����û������200mL 3.00mol/L��NaOH��Һ(�ܶ�Ϊ1.12g/mL)ǡ����ȫ���ա�
����ԭNaOH��Һ����������_______________���������С����ʾ������3λС����
����������Һ��Cl����ClO�������ʵ���֮��__________________��
������Һ��ClO�������ʵ���_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
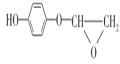
����Ŀ������ľ����ά�ɺϳ�ҩ���м���H�����ܺϳɸ߷��ӻ�����G���ϳ�·�����£�

��֪��
��![]() ��
��![]()
��1��A�Ļ�ѧ������___________________��
��2��B�Ľṹ��ʽ��_____________����C����D�ķ�Ӧ����Ϊ_____________________��
��3��������E�Ĺ�����Ϊ__________________________��
��4��F�����д���ͬһƽ���ԭ�������___________����F����G�Ļ�ѧ��Ӧ����ʽΪ_________________________________��
��5�����㻯����IΪH��ͬ���칹�壬������һ�ȴ��������ֽṹ��1molI����ˮ�ⷴӦ����2mol NaOH������Ҫ���ͬ���칹����______�֣����к˴Ź���������ʾ��4�ֲ�ͬ��ѧ�������⣬�������Ϊ6:3:2:1��I�ṹ��ʽΪ__________________________��
��6��д���� Ϊԭ���Ʊ�
Ϊԭ���Ʊ�![]() �ĺϳ�·�ߣ������Լ���ѡ��__________��
�ĺϳ�·�ߣ������Լ���ѡ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���¶��£����������ܱ������У��������淴Ӧ N2(g)��3H2(g) ![]() 2NH3(g)������˵������ȷ����
2NH3(g)������˵������ȷ����
A. �����ܱ��������ٳ���N2����Ӧ���ʼ���
B. ����Ӧǰ10sʱ��H2������0��3mol����v(H2)=0.03mol��L-1��s-1
C. ��ijʱ��N2��H2��NH3��Ũ�Ȳ��ٷ����仯��������÷�Ӧ�ﵽ��ƽ��״̬
D. ��ijʱ��������1 molN2ͬʱ������2 molNH3��������÷�Ӧ�ﵽ��ƽ��״̬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(1)˳��(��ѧ����Ϊ˳���ȶ����ϲ�(II)����ѧʽΪPtCl2(NH3)2����Է�������Ϊ��300)��һ���������ư�֢��ҩ�һƬ˳��ҩƬ����˳��������Ϊ6��10-4g����ôһƬ˳��ҩƬ��Nԭ�ӵ����ʵ���________��
(2)��ϩ���壨C2H4����ʯ�ͻ�����Ʒ֮һ��Ҳ������Ҫ���л���������ԭ��֮һ���ڱ�״�������ܶ�Ϊ_______g.L-1��(��֪����״���£�Vm=22.4Lmol-1 )
(3)����һ�ֿ�Ȫˮ��Ʒ��1.0���ĸÿ�Ȫˮ����4.8��10-2gMg2+����________����Ȫˮ�к���1molMg2+��
(4)ij��84����Һ��1000mL������Ч�ɷ�ΪNaClO(ʽ����74.5)����������Ϊ14.9�����ܶ�Ϊ1.2g/L�������ʵ����ʵ���Ũ��Ϊ________��
(5)��֪CO��CO2�Ļ������7.2g���ڱ�״������ռ�����Ϊ4.48L����û����������Ԫ�ص�����Ϊ_______��
(6)��ͼ��ʾ��ƿ�����ȵ����壬��ͬ��ͬѹ�£���ƿ1��������______���������ʵ���������������������ȣ�����ƿ�е�����ԭ����������������ȡ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������(AlN)��һ�����ͷǽ������ϣ��������ܻ���ˮ�⡣���������ڵ�����Χ��1700��ϳɣ�����Ϊ��ɫ������ɫ��ĩ��ijС��̽����ʵ�����Ʊ�AlN���ⶨ��Ʒ���ȣ����ʵ�����¡���ش�
(һ)�Ʊ�AlN

(1)�������������ҵķ�������װ�õ���ȷ����˳��Ϊj��__________________��i(�������ӿ���ĸ���)��
(2)ʵ��ʱ���Կ���Ϊԭ���Ʊ�AlN��װ��A�л�ԭ���۵�����Ϊ________________��װ��B���Լ�XΪ_____________________��
(��)�ⶨ��Ʒ����
ȡm g�IJ�Ʒ��������װ�òⶨ��Ʒ��AlN�Ĵ���(�г�װ������ȥ)��
��֪��AlN + NaOH + H2O �� NaAlO2 + NH3��
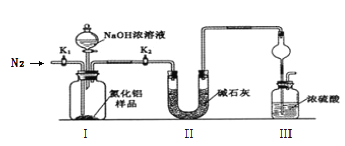
(3)�������ʵ�鲽�裺��װ��ʵ��װ�ã�����_________________________________������ʵ��ҩƷ����������ʵ������ǹر�______________________________����______________���ٴ�Һ©��������������NaOHŨ��Һ��رգ������ٲ������塣��______________��ͨ�뵪��һ��ʱ�䣬�ⶨװ��III��Ӧǰ��������仯Ϊn g��
(4)ʵ����������Ʒ��AlN�Ĵ���Ϊ___________��(�ú�m��n�Ĵ���ʽ��ʾ)��
(5)����ʵ��������Ȼ����ȱ�ݣ�����Ϊ���ܵ�ȱ�ݼ��ᵼ�µIJⶨ���____________(�� ��ƫ��������ƫ��������)���______________________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪����ƽ�ⳣ��H2SO3��H2SO3HSO3- + H+ K1=1.54��10-2 ��HSO3SO32- + H+ K2=1.02��10-7�� H2CO3��H2CO3HCO3- + H+ K1=4.4��10-7HCO3-CO32- + H+ K2=4.7��10-11������Һ�в����Դ����������������
A. HSO3-��CO32- B. HSO3-��HCO3-
C. SO32-��HCO3- D. SO32-��CO32-
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com