
【题目】下列关于化学键的叙述,正确的是( )
A.含有共价键的化合物一定是共价化合物
B.单质分子中均不存在化学键
C.离子化合物中一定含有离子键
D.非金属元素形成的化合物一定是共价化合物
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
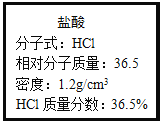
(1)该浓盐酸的物质的量浓度为___。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是___。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液中Cl-的数目 D.溶液的密度
(3)某学生欲用上述浓盐酸和蒸馏水配制450mL物质的量浓度为0.3mol/L稀盐酸。
①该学生需要量取____mL上述浓盐酸进行配制。
②配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次)___;
A.用30mL水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需浓盐酸的体积,慢慢沿杯壁注入盛有少量水(约30mL)的烧杯中,用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入500mL的容量瓶中
D.将容量瓶盖紧,颠倒摇匀
E.改用胶头滴管加水,使溶液凹面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线1~2cm处
③在配制过程中,下列实验操作对所配制的稀盐酸的物质的量浓度有何影响?(填“偏高”或“偏低”或“无影响”)。
I、用量筒量取浓盐酸时俯视观察凹液面____
II、溶液注入容量瓶前没有恢复到室温就进行定容___
(4)若在标准状况下,将VLHCl气体溶于1L水中,所得溶液密度为dg/mL,则此溶液的物质的量浓度为___mol·L-1(填字母)
A.![]() B.
B.![]() C.
C.![]() D.
D.![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液,一定呈中性的是
A. 由等体积、等物质的量浓度的硫酸跟NaOH溶液混合后所形成的溶液
B. c(H+)=1.0×10-7mol·L-1的溶液
C. pH=7的溶液
D. c(H+)=![]() 的溶液(Kw为该温度下水的离子积常数)
的溶液(Kw为该温度下水的离子积常数)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铵俗称卤砂,主要用于干电池、化肥等。某化学研究小组设计如下实验制备卤砂并进行元素测定。
I.实验室用NH3和HCl气体在A中制备卤砂,所需装置如下。
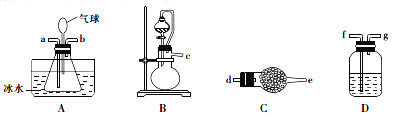
(1)装置接口连接顺序是____________→a; ___________→b。(装置可重复选用)
(2)C装置的作用是__________________,D装置盛装的物质是__________________。
(3)写出用上述装置制备氨气的一组试剂:_____________________。
II.测定卤砂中Cl元素和N元素的质量之比。
该研究小组准确称取ag卤砂,与足量氧化铜混合加热,充分反应后把气体产物按下图装置进行实验。收集装置收集到的气体为空气中含量最多的气体,其体积换算成标准状况下的体积为VL,碱石灰增重bg。
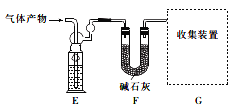
(4)E装置内的试剂为__________,卤砂与氧化铜混合加热反应的化学方程式为_______________。
(5)卤砂中Cl元素和N元素的质量之比为__________________(用含b、v的式子表示)。
(6)为了测定卤砂中氯元素的质量,他们设计的实验方案是将ag卤砂完全溶解于水,加入过量AgNO3溶液,然后测定生成沉淀的质量。请你评价该方案是否合理,并说明理由_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚氯酸钠(NaClO2)在溶液中会生成ClO2、HClO2、ClO2-、Cl-等,其中HClO2和ClO2都是具有漂白作用。已知pOH=-lgc(OH-),经测定25℃时各组分含量随pOH变化情况如图所示(Cl-没有画出),此温度下,下列分析正确的是

A. HClO2的电离平衡常数的数值Ka=10-8
B. pOH=11时,ClO2-部分转化成ClO2和Cl-离子的方程式为:5ClO2-+2H2O=4ClO2+ Cl-+4OH-
C. pH=7时,溶液中含氯微粒的浓度大小为:c(HClO2)>c(ClO2-)>c(ClO2)>c(Cl-)
D. 同浓度的HClO2溶液和NaClO2溶液等体积混合,则混合溶液中有:c(Na+)+c(OH-)=c(H+)+ c(HClO2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜广泛应用于有机合成、石油、油脂、染料等工业。以某种铜矿粉(含Cu2S、CuS及FeS等)为原料制取CuCl的工艺流程如下:
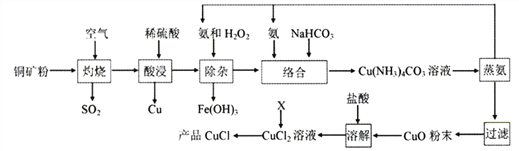
已知:①CuS、Cu2S、FeS灼烧固体产物为Cu2O、FeO;
②Ksp(CuCl)=2×10-7,2Cu+=Cu+Cu2+的平衡常数K1=1×106
回答下列问题:
(1)“灼烧”时,被还原的元素有____________(填元素符号)。
(2)“酸浸”所需H2SO4是用等体积的98%H2SO4和水混合而成。实验室配制该硫酸溶液所需的玻璃仪器除玻璃棒、胶头滴管外,还有_______。“酸浸”时硫酸不宜过多的原因是__________________。
(3)“除杂”的总反应方程式是_____________________。
(4)“络合”反应中的NH3与NaHCO3理论比值是____________________。
(5)加热“蒸氨”在减压条件下进行的原因是________________。
(6)X可以充分利用流程中的产物,若X是SO2时,通入CuCl2溶液中反应的离子方程式是________________;若X是Cu时,反应Cu+Cu2++2Cl-=2CuCl的平衡常数K2=_________。
(7)以铜为阳极电解NaCl溶液也可得到CuCl,写出阳极电极反应式__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】G(对羟基苯乙酸)是合成某治疗高血压药物的中间体。一种由芳香烃A制备G的合成路线如下图所示。

请回答下列问题:
(1)A的名称为___________。
(2)试剂M是___________。B→C的反应类型是___________。
(3)E的结构简式为___________。F中含有官能团的名称是___________。
(4)写出D→E反应的化学方程式:___________。
(5)H是G的同分异构体,且满足下列条件:①与FeCl3溶液发生显色反应;②核磁共振氢谱有5组峰,峰面积之比为1︰2︰2︰2︰1。请写出3个符合条件的H的结构简式:___________。
(6)苯甲酸可用于染料载体、香料及增塑剂等的生产。参考题目中的有关信息,设计由苯制备苯甲酸的合成路线(无机试剂自选):___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com