
| 28.4g |
| 71g/mol |
| 28.4g |
| 71g/mol |
| 67.2L×0.4mol |
| 4mol |
| 4mol |
| 0.4mol |
| 4mol |
| Y |


科目:高中化学 来源: 题型:
| A、P的非金属性比N强,对应的单质白磷比氮气活泼 |
| B、工业上通常用电解Na、Fe、Cu对应的氯化物制得该三种金属单质 |
| C、氨易液化、硫化氢在同族元素的氢化物中熔沸点最低可用同一原理解释 |
| D、Cl、Br、I的非金属性逐渐减弱,HCl、HBr、HI水溶液的酸性逐渐减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、含有NA个氦原子的氦气在标准状况下的体积约为11.2 L |
| B、25℃1.01×105 Pa,64 g SO2中含有的原子数为3NA |
| C、0℃101千帕,11.2L氮气所含的原子数目为NA |
| D、17g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性氧化物:Na2O、CaO、MgO、Na2O2 |
| B、碱:NaOH、KOH、Ba(OH)2、Na2CO3 |
| C、铵盐:NH4Cl、NH4NO3、(NH4)2SO4、NH3?H2O |
| D、非金属氧化物:CO2、NO、SO2、H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、是氢元素的一种新的同素异形体 |
| B、是氢元素的一种新的同位素 |
| C、该微粒比普通氢分子多一个氢原子核 |
| D、该微粒的组成可用H3表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
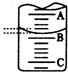 某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:
某化学实验小组想要了解市场上所售食用白醋(主要是醋酸的水溶液)的准确浓度,现从市场上买来一瓶某品牌食用白醋,在实验室用标准NaOH溶液对其进行滴定.下表是4种常见指示剂的变色范围:| 指示剂 | 石蕊 | 甲基橙 | 甲基红 | 酚酞 |
| 变色范围(pH) | 5.0~8.0 | 3.1~4.4 | 4.4~6.2 | 8.2~10.0 |
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 消耗NaOH溶液体积/mL | 26.02 | 25.35 | 25.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、容器内的压强不再发生变化 |
| B、混合气体的物质的量不再变化 |
| C、单位时间内消耗 3a mol X,同时生成 2a mol Z |
| D、Y生成的速率与Y分解的速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
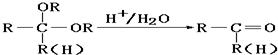

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com