
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是
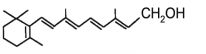
A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质都是由分子构成,且都是共价化合物的一组是( )
A. 干冰、蔗糖水、液氧 B. 硫酸、液氨、酒精
C. 浓硫酸、氮气、葡萄糖 D. C60、 酒精、碳酸氢铵
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应 C(s)+ H2O(g)= CO(g)+ H2(g)下列条件的改变使其反应速率减慢的是( )
A.增加 C 的量B.将容器的体积缩小一半
C.恒容,充入 H2O(g)使体系压强增大D.恒压,充入 N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化二钴(Co2O3)常用于制滤光眼镜的添加剂、催化剂和氧化剂。以含钴废料(主要成分CoO、Co2O3,含有少量MnO2、NiO、Fe3O4)为原料制备Co2O3的流程如下:
(1)研磨的目的是____________。滤渣1的主要成分为______________(填化学式)。
(2)酸浸时双氧水的作用有___________。不能用盐酸代替硫酸,因为Co2O3与盐酸反应生成Cl2,污染境,该反应的离子方程式为__________。
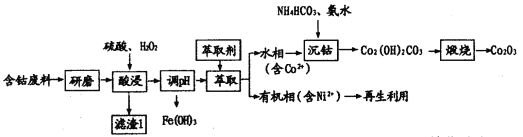
(3)在实验室里,萃取操作要用到的玻璃仪器主要有___________。有机相再生时提取出的Ni2+可用于制备氢镍电池,该电池充电时的总反应为Ni(OH)2+M![]() NiOOH+MH。则放电时正极的电极反应式为__________。
NiOOH+MH。则放电时正极的电极反应式为__________。
(4)沉钴时发生反应的离子方程式为_______。煅烧时发生反应的化学方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁晶体(FeC2O4·xH2O)为淡黄色粉末,不溶于水,可作照相显影剂和制药工业,某化学兴趣小组对其性质进行如下探究。回答下列问题:
Ⅰ.定性探究
选用下列试剂设计实验方案,完成下表内容。
试剂:酸性KMnO4 溶液、H2O2 溶液、KSCN 溶液
操作 | 现象 | 结论与解释 |
(1)取少量草酸亚铁晶体于试管中,加入2mL 水,振荡后静 置 | 有淡黄色沉淀,上层清液无色 | ___________________________ |
(2)继续加入2mL稀硫酸,振荡 | 固体溶解,溶液变为浅绿色 | 草酸亚铁溶于硫酸,硫酸酸性____草酸(填“强于”、“弱于”或“等于”) |
(3)向步骤(2)所得溶液中滴加几滴K3[Fe(CN)6]溶液 | ___________ | 含有Fe2+ |
(4)________________________________ | ___________ | H2C2O4 或C2O42-具有还原性 |
Ⅱ.定量探究:滴定实验测x 的值
(5)滴定前,下列操作的正确顺序是c→ _________ →d(填字母序号)。
a.排尽滴定管尖嘴的气泡并调整液面 b.盛装0.1000 mol·L-1 的酸性KMnO4 溶液
c.查漏、清洗 d.初始读数、记录为0.50 mL
e.用0.1000 mol·L-1 的酸性KMnO4 溶液润洗
(6)称取 m 克样品,加入适量稀硫酸溶解,用步骤(5)准备的标准KMnO4 溶液直接滴定,溶解时最适合的玻璃仪器是_______________ ,滴定反应的氧化产物是________________。
(7)终点读数为20.50mL。结合上述实验数据求得x=____________(用含m 的代数式表示,FeC2O4 的相对分子质量为144)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容中加入2.0molSO2和1.0molO2,一定条件下发生如下反应2SO2+O2![]() 2SO3。反应达到平衡后,各物质的物质的量可能为( )
2SO3。反应达到平衡后,各物质的物质的量可能为( )
n(SO2)/mol | n(O2)/mol | n(SO3)/mol | |
A | 2.0 | 1.0 | 0 |
B | 1.0 | 0.8 | 1.0 |
C | 0.20 | 0.10 | 1.80 |
D | 0 | 0 | 2.0 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
A. V(A)=0.15mol/(L·min)B. V(B)=0.6mol/(L·min)
C. V(C)=0.4mol/(L·min)D. V(D)=0.0075 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_________________________________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
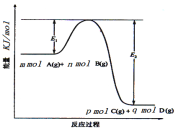
该反应△H =____(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题:
①该反应的ΔH=__________填“>”、“=”或“<”)。
②已知在一定温度下,C(s) +CO2 (g)![]() 2CO(g)平衡常数K1;C (s) +H2O (g)
2CO(g)平衡常数K1;C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,请按要求填空:
A | B | C | |||||||||||||||
D | E | F | G | ||||||||||||||
H | I | ||||||||||||||||
(1)A元素的最高价氧化物的电子式______。
(2)元素G在周期表中的位置是_______。
(3)C与D简单离子中半径较大的是________(用离子符号表示)。
(4)C与F的气态氢化物中较稳定是________(用化学式表示)。
(5)写出G单质与I的最高价氧化物对应水化物的溶液反应的化学方程式______。
(6)下列说法或实验不能证明H和I两种元素的金属性强弱的是_____。
a 比较两种元素的单质的熔点、沸点高低
b 将两种元素的单质分别与冷水反应,观察反应的剧烈程度
c 比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com