
【题目】反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
A. V(A)=0.15mol/(L·min)B. V(B)=0.6mol/(L·min)
C. V(C)=0.4mol/(L·min)D. V(D)=0.0075 mol/(L·s)
科目:高中化学 来源: 题型:
【题目】某有机物A可用于合成药物达菲,其结构简式如图,

下列关于A的说法不正确的是( )
A. 分子式为C7H6O5
B. 和溴水既可以发生取代反应,又可以发生加成反应
C. 1 mol该化合物最多可以与含4 mol NaOH的溶液反应
D. 既可以和FeCl3溶液发生显色反应,又可以和NaHCO3溶液反应放出CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)反应Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)
FeO(s)+CO(g) ΔH1,平衡常数为K1;反应Fe(s)+H2O(g)![]() FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
FeO(s)+H2(g) ΔH2,平衡常数为K2;在不同温度时K1、K2的值如下表:
700 ℃ | 900 ℃ | |
K1 | 1.47 | 2.15 |
K2 | 2.38 | 1.67 |
①反应CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)
CO(g)+H2O(g) ΔH的平衡常数为K,则ΔH=________(用ΔH1和ΔH2表示),K=________(用K1和K2表示),且由上述计算可知,反应CO2(g)+H2(g)![]() CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
CO(g)+H2O(g)是_____________________反应(填“吸热”或“放热”)。
②能判断CO2(g)+H2(g)![]() CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
CO(g)+H2O(g)达到化学平衡状态的依据是_______(填字母)。
A.容器中压强不变 B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O) D.c(CO)=c(CO2)
(2)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,发生反应:Fe(s)+CO2(g)![]() FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。
FeO(s)+CO(g) ΔH>0,CO2的浓度与时间的关系如图所示。

①该条件下反应的平衡常数为______;若铁粉足量,CO2的起始浓度为2.0 mol·L-1,则平衡时CO2的浓度为______mol·L-1。
②下列措施中能使平衡时 增大的是________(填字母)。
增大的是________(填字母)。
A.升高温度 B.增大压强
C.充入一定量的CO2 D.再加入一定量铁粉
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人体缺乏维生素A,会出现皮肤干燥、夜盲症等症状。维生素A又称视黄醇,分子结构如下图所示,下列说法正确的是
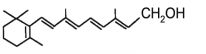
A. 1mol维生素A最多能与7molH2发生加成反应
B. 维生素A不能被氧化得到醛
C. 维生素A是一种易溶于水的醇
D. 维生素A的分子式为C20H30O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应C(s)+H2O(g)![]() CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
CO(g)+H2(g)在一定容积的密闭容器中进行,则下列说法或结论中,能够成立的是( )
A. 其他条件不变仅将容器的体积缩小一半,反应速率减小
B. 保持体积不变,充入少量He气体使体系压强增大,反应速率一定增大
C. 反应达平衡状态时:v(CO)正=v(H2O)逆
D. 其他条件不变,适当增加C(s)的质量会使反应速率增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2×10- 5mol/LKCl 与2×10- 5mol/LAgNO3溶液等体积混合,下列说法正确的是 (已知AgCl 的Ksp=1.8×10-10 )
A.有AgCl沉淀析出B.无AgCl沉淀析出
C.无法确定有无AgCl沉淀析出D.有沉淀但不是AgCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(一)有下列各组物质:① 126C和136C;②石墨和足球烯;③漂白粉和漂白液主要成分 ④正丁烷和异庚烷;⑤乙烯和聚乙烯;⑥![]() 和
和 ;⑦丙烷和环丙烷 ⑧CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3。用序号填空:
;⑦丙烷和环丙烷 ⑧CH3-CH2-CH2-CH3 和CH3-CH(CH3)CH3。用序号填空:
(1)____________组两者互为同系物。
(2)____________组两者互为同分异构体
(3)____________组两者属于同位素。
(4)____________组两者互为同素异形体。
(5)____________组两者是同一物质。
(二)乙烯在化工生产领域应用广泛。
(1)乙烯能合成很多有实用价值的有机物。

①试剂a是_____________。
②反应Ⅰ的反应类型是_____________。
(2)以原油为起始原料合成聚乙烯的路线如下图所示。
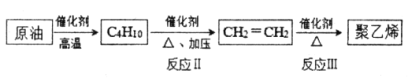
①反应Ⅲ的化学方程式是_____________。
②写出分子式符合C4H10的有机物的结构简式_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 加入铝粉能放出氢气的溶液: Na+、Cl-、SO42-、Fe3+
B. 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(OHˉ)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D. 碳酸钠溶液:K+、SO42-、Cl-、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上采用如下反应合成甲醇:CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
(1)分析该反应并回答下列问题:
①该反应的平衡常数表达式为K=____________。
②下列选项能判断该反应达到平衡状态的依据有__________(填序号)。
A.2v(正)(H2)= v(逆)(CO)
B.一定条件下,单位时间内消耗2molH2的同时生成 1mol CH3OH
C.恒温、恒容时,容器内的压强不再变化
D.恒温、恒容时,容器内混合气体的密度不再变化
E.混合气体的平均相对分子质量不随时间而变化
(2))下图是该反应在不同温度下CO转化率随时间的变化曲线:

①该反应的△H________0(填“>”、“<”或“=”)。
②T1和T2温度下的平衡常数:K1 ________ K2(填“>”、“<”或“=”)。
(3)某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为________________。
(4)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式________________________。
(5)2009年10月,中国科学院长春应用化学研究所在甲醇燃料电池技术方面获得新突破,组装出了自呼吸电池及主动式电堆。甲醇燃料电池的工作原理如图所示。

①该电池工作时,b口通入的物质为__________(填 化学式,下同),c 口通入的物质为__________。 ②该电池正极的电极反应式为_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com