
【题目】在下列溶液中,各组离子一定能够大量共存的是( )
A. 加入铝粉能放出氢气的溶液: Na+、Cl-、SO42-、Fe3+
B. 使紫色石蕊试液变红的溶液:Fe2+、Mg2+、NO3-、Cl-
C. c(OHˉ)=10-12 mol·L-1的溶液:K+、Ba2+、Cl-、Br-
D. 碳酸钠溶液:K+、SO42-、Cl-、H+
 特高级教师点拨系列答案
特高级教师点拨系列答案科目:高中化学 来源: 题型:
【题目】反应 C(s)+ H2O(g)= CO(g)+ H2(g)下列条件的改变使其反应速率减慢的是( )
A.增加 C 的量B.将容器的体积缩小一半
C.恒容,充入 H2O(g)使体系压强增大D.恒压,充入 N2使容器体积变大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应A+3B=2C+2D在不同条件下反应速率如下,其中最快的是( )
A. V(A)=0.15mol/(L·min)B. V(B)=0.6mol/(L·min)
C. V(C)=0.4mol/(L·min)D. V(D)=0.0075 mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知CH3OH(l)的燃烧热ΔH=-238.6 kJ/mol,CH3OH(l)+3/2O2(g)===CO2(g)+2H2O(g)ΔH=-a kJ/mol,则 a___238.6(填“>”、“<”或“=”)。
(2)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,当有1 mol Cl2参与反应时释放出145 kJ热量,写出该反应的热化学方程式:_________________________________。
(3)反应mA(g)+nB(g)![]() pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
pC(g) +qD(g)过程中的能量变化如图所示,回答下列问题。
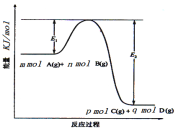
该反应△H =____(用含E1、E2式子表示);在反应体系中加入催化剂,E1___,E2___,(填增大、减小、不变)。
(4)已知:CO (g) +H2O (g)![]() H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
H2 (g) +CO2 (g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题:
①该反应的ΔH=__________填“>”、“=”或“<”)。
②已知在一定温度下,C(s) +CO2 (g)![]() 2CO(g)平衡常数K1;C (s) +H2O (g)
2CO(g)平衡常数K1;C (s) +H2O (g)![]() CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
CO(g) +H2 (g)平衡常数K2。则K、K1 、K2之间的关系是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.羰基硫(COS)广泛存在于以煤为原料的各种化工原料气中,能引起催化剂中毒、化学产品质量下降和大气污染,研究其脱除方式意义重大。回答下列问题:
(1)COS 的分子结构与 CO2 相似,COS 的电子式为_____。
(2)已知:① CO(g)+H2O(g) ![]() H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
H2(g)+CO2(g) ΔH1=-41.2 kJ·mol-1
② COS(g)+H2O(g) ![]() H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
H2S(g)+CO2(g) ΔH2=-35.5 kJ·mol-1
则氢气脱除 COS 生成 CO 和 H2S 的热化学方程式为________________________________。
II. 通常人们把拆开 1 mol 某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的反应热(△H),化学反应的△H 等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g) = Si(s) + 4HCl(g) △H = + 236 kJ/mol
键能 | Si—O | Si—Cl | H—H | H—Cl | Si—Si | Si—C |
(kJ·mol-1) | 460 | 360 | 436 | 431 | x | 347 |
表中 x=_____。
Ⅲ. “绿水青山就是金山银山”,利用原电池原理(6NO2 +8NH3 = 7N2+12H2O)可以处理氮的氧化物和NH3 尾气,装置原理图如图:

负极反应式为____________, 标准状况下有 4.48 L NO2 被处理时,转移电子的物质的量为_______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃烧产生的尾气中含有一定量的NO。科学家们设计了一种间接电处理法除去其中NO的装置,如下图所示,它可以将NO转化为NH4+。下列说法正确的是
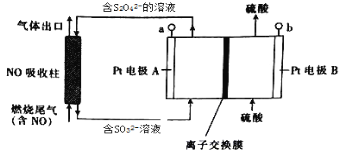
A. a连接电源的正极
B. Pt电极B上发生的电极反应为2H2O-4eˉ=O2↑+4H+
C. 当NO吸收柱中产生1mol SO32ˉ时,理论上处理的NO气体的体积为8.96L(标准状况)
D. 图中的离子交换膜应为阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下面是元素周期表的一部分,请按要求填空:
A | B | C | |||||||||||||||
D | E | F | G | ||||||||||||||
H | I | ||||||||||||||||
(1)A元素的最高价氧化物的电子式______。
(2)元素G在周期表中的位置是_______。
(3)C与D简单离子中半径较大的是________(用离子符号表示)。
(4)C与F的气态氢化物中较稳定是________(用化学式表示)。
(5)写出G单质与I的最高价氧化物对应水化物的溶液反应的化学方程式______。
(6)下列说法或实验不能证明H和I两种元素的金属性强弱的是_____。
a 比较两种元素的单质的熔点、沸点高低
b 将两种元素的单质分别与冷水反应,观察反应的剧烈程度
c 比较两种元素的最高价氧化物对应的水化物的碱性强弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究苯与溴的取代反应,甲同学用装置I进行如下实验:
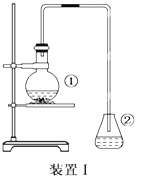
将一定量的苯和溴放在烧瓶中,同时加入少量铁屑做催化剂,3-5分钟后发现滴有AgNO3的锥形瓶中有浅黄色沉淀生成,即证明苯与溴发生了取代反应。
(1)装置I中①的化学方程式为____________________。
(2)①中长导管的作用是____________________。
(3)要得到纯净的产物,可用稀NaOH溶液、蒸馏水洗涤。洗涤分离粗产品后,检验产物已洗净的方法是_____________________。
(4)乙同学设计如图所示装置II,并用下列某些试剂完成该实验。可选用的试剂是:苯、液溴、浓硫酸、氢氧化钠溶液、硝酸银溶液、四氯化碳。
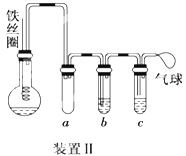
a的作用是________________。能证明苯和液溴发生的是取代反应,而不是加成反应,则试管b中应加入_______________,试管c中应加入________________。
(5)比较两套装置,装置Ⅱ的两个优点是:①__________________②____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com