
【题目】醋酸和盐酸分别是常见的一元弱酸和强酸.
(1)醋酸在水溶液中的电离方程式为_________________。
(2)科学家提出了用酸度(AG)表示溶液酸碱性的概念,规定:AG=lg![]() 则pH=3的醋酸溶液的AG=_________________。
则pH=3的醋酸溶液的AG=_________________。

(3)用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________________(填“I”或“II”)。
②V1和V2的关系:V1_________V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是________________。
科目:高中化学 来源: 题型:
【题目】离子液体是一类具有很高应用价值的绿色溶剂和催化剂,其中的EMIM+离子由H、C、N三种元素组成,结构如图所示。回答下列问题:
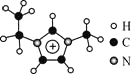
(1)碳原子价层电子的轨道表达式为__________,基态碳原子中,核外电子占据的最高能级的电子云轮廓图为_________形。
(2)根据价层电子对互斥理论,NH3、NO3-、NO2-中,中心原子价层电子对数不同于其他两种粒子的是_______;NO3-与NO2-中O-N-O的键角:NO3-____ NO2-(填“<”、“>”“=”)。
(3)EMIM+离子与金属阳离子形成的离子化合物常温下呈液态的原因是____________。
(4)EMIM+离子中,碳原子的杂化轨道类型为___________。分子中的大π键可用符号πnm表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数,则EMIM+离子中的大π键应表示为________。
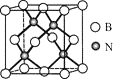
(5)立方氮化硼硬度仅次于金刚石,但热稳定性远高于金刚石,其晶胞结构如图所示。立方氮化硼属于_______晶体,其中硼原子的配位数为_______。已知:立方氮化硼密度为dg/cm3,B原子半径为xpm,N原子半径为ypm,阿伏加德罗常数的值为NA,则该晶胞中原子的空间利用率为________(列出化简后的计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知NaHA水溶液呈碱性。
①用离子方程式表示NaHA水溶液呈碱性的原因__________________(用离子方程式和相应的文字叙述)。
②在NaHA水溶液中各离子浓度的大小关系是_______________________________
(2)实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的_____(填写物质的名称)。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________(填化学式)。
(3)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(![]() )从大到小顺序为__________________(填序号)。
)从大到小顺序为__________________(填序号)。
(4)常温下,pH=5的盐酸和pH=9的氢氧化钠溶液等体积混合,则混合液的pH=_________。
(5)毒重石的主要成分BaCO3(含Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备BaCl2·2H2O的流程如下:

已知:
Ca2+ | Mg2+ | Fe3+ | |
开始沉淀时的pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的pH | 13.9 | 11.1 | 3.2 |
已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9
加入NH3·H2O调pH=8可除去______(填离子符号),滤渣Ⅱ中含________(填化学式)。加入H2C2O4时应避免过量,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2NO2 ![]() N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )
N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )

A.(1)中红棕色变深,(2)中红棕色变浅
B.(1)中红棕色变浅,(2)中红棕色变深
C.烧瓶(1)中气体的压强不变
D.烧瓶(2)中气体的压强增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于分子式为C4H8O2的有机物的同分异构体的说法中,不正确的是( )
A. 属于酯类的有4种
B. 属于羧酸类的有2种
C. 既含有羟基又含有醛基的有3种
D. 存在分子中含有六元环的同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,设计实验方案并记录如下
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合得到浊液W,过滤,得到滤液X和白色沉淀Y
Ⅱ.向滤液X中滴加几滴饱和Na2S溶液 出现浑浊
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 沉淀变为黑色
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 沉淀逐渐溶解
(1)步骤Ⅰ的浊液W中存在的沉淀溶解平衡为_______________;
(2)由步骤Ⅱ的浑浊可推测,滤液X中除了含有Na+、NO3﹣,还含有的离子有_______________;
(3)能说明步骤Ⅲ中沉淀变黑的离子方程式为____________.沉淀转化的主要原因是_____________;
(4)已知:Ag++2NH3H2O===Ag(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因______________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】不同温度下,水溶液中c(H+)与 c(OH+)的关系如图所示,下列说法正确的是

A.若从a点到c点,可采用在水中加入酸的方法
B.b点对应的醋酸中由水电离的c(H+)=10-6mol·L-1
C.T ℃时,0.05 mol·L-1的Ba(OH)2溶液的pH=11
D.c点对应溶液的Kw大于d点对应溶液的Kw
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿石主要成分有磁铁矿(Fe3O4)、锰矿(MnO2和MnCO3)、氧化铝(Al2O3)、石棉Mg3Si3O7(OH)4等。其中锰矿含量大于磁铁矿含量。工业上将该矿石处理后提取铝的工业流程如下:

已知:二氧化锰难溶于水、稀硫酸,溶于热浓盐酸。碳酸锰不溶于水,溶于稀硫酸。
(1)MnO2和MnCO3中,Mn元素的化合价分别是_________。
(2)石棉化学式为Mg3Si3O7(OH)4,它与硫酸反应的化学方程式为_________。
(3)滤渣A为____________(填化学式)
(4)步骤②中加入氢氧化钠的作用是_________。
(5)已知不同金属离子生成氢氧化物沉淀所需的pH如表:
离子 | Fe3+ | Al3+ | Fe2+ | Mg2+ | Mn2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 9.3 | 7.8 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 10.8 | 9.8 |
步骤②中加入氢氧化钠调节溶液的pH等于11,则滤渣B的成份是________。
(6)步骤③是往滤液中加入一种物质后过滤,这种物质是__________,过滤操作中使用的玻璃仪器有漏斗、_________;由D电解制备铝的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】秸秆(含多糖类物质)的综合利用具有重要的意义。下面是以秸秆为原料合成聚酯类高分子化合物的路线:

回答下列问题:
(1)下列关于糖类的说法正确的是___。(填标号)
a.糖类都有甜味,具有CnH2mOm的通式
b.麦芽糖水解生成互为同分异构体的葡萄糖和果糖
c.用银镜反应不能判断淀粉水解是否完全
d.淀粉和纤维素都属于多糖类天然高分子化合物
(2)B生成C的反应类型为___。
(3)D中的官能团名称为___,D生成E的反应类型为___。
(4)F 的化学名称是___,由F生成G的化学方程式为____。
(5)具有一种官能团的二取代芳香化合物W是E的同分异构体,0.5molW与足量碳酸氢钠溶液反应生成44gCO2,W共有____种(不含立体异构),其中核磁共振氢谱为三组峰的结构简式为____。
(6)参照上述合成路线,以(反,反)2,4己二烯和C2H4为原料(无机试剂任选),设计制备对苯二甲酸的合成路线____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com