
����Ŀ��ij��ʯ��Ҫ�ɷ��д�����(Fe3O4)���̿�(MnO2��MnCO3)��������(Al2O3)��ʯ��Mg3Si3O7(OH)4�ȡ������̿������ڴ�����������ҵ�Ͻ��ÿ�ʯ��������ȡ���Ĺ�ҵ�������£�

��֪����������������ˮ��ϡ���ᣬ������Ũ���ᡣ̼���̲�����ˮ������ϡ���ᡣ
(1)MnO2��MnCO3�У�MnԪ�صĻ��ϼ۷ֱ���_________��
(2)ʯ��ѧʽΪMg3Si3O7(OH)4���������ᷴӦ�Ļ�ѧ����ʽΪ_________��
(3)����AΪ____________(�ѧʽ)
(4)������м����������Ƶ�������_________��
(5)��֪��ͬ����������������������������pH�����
���� | Fe3+ | Al3+ | Fe2+ | Mg2+ | Mn2+ |
��ʼ������pH | 2.7 | 3.7 | 7.0 | 9.3 | 7.8 |
��ȫ������pH | 3.7 | 4.7 | 9.6 | 10.8 | 9.8 |
������м����������Ƶ�����Һ��pH����11��������B�ijɷ���________��
(6)�����������Һ�м���һ�����ʺ���ˣ�����������__________�����˲�����ʹ�õIJ���������©����_________����D����Ʊ����Ļ�ѧ����ʽΪ_____________��
���𰸡�+4��+2 Mg3Si3O7(OH)4+3H2SO4=3MgSO4+3H2SiO3��+2H2O MnO2��H2SiO3 ��Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ʹAl3+ת��ΪAlO2�� Fe(OH)3��Mg(OH)2��Mn(OH)2 CO2 �ձ��������� 2Al2O3![]() 4Al+O2��
4Al+O2��
��������
(1)��������Ԫ�ػ��ϼ�֮��Ϊ0��
(2)ʯ�������ﻯѧʽΪ��3MgO3SiO22H2O���ݴ˷�����
(3)��������Ҫ�ɷ��Dz����������ˮ�����ʣ�
(4)������������Һ���������ҺpHֵ��ʹ�������ӱ�Ϊ������
(5)���ݱ������ݽ��з�����ע�����������������ܽ⣻
(6)��ƫ������ת���ɳ����ķ�����ͨ����������̼��������Ҫ©�������������ձ���
(1)MnO2����Ԫ��Ϊ-2�ۣ�����MnΪ+4�ۣ�MnCO3����Ԫ��Ϊ-2�ۣ�̼Ԫ��Ϊ+4�ۣ�����MnԪ��Ϊ+2�ۣ��ʴ�Ϊ��+4��+2��
(2)ʯ�������ﻯѧʽΪ��3MgO3SiO22H2O�������ᷴӦ��������þ����������ʴ�Ϊ��Mg3Si3O7(OH)4+3H2SO4=3MgSO4+3H2SiO3��+2H2O��
(3)����(2)��֪�����˲�������Ĺ��ᣬͬʱ������Ŀ������Ϣ��֪MnO2������ˮ��ϡ���ᣬ�ʴ�Ϊ��MnO2��H2SiO3��
(4)�������˺���Һ�д���Fe3+��Fe2+��Mg2+��Mn2+��Al3+�����ӣ������������ƿ��Խ�Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ͬʱ����ʹAl3+ת��ΪAlO2-���ʴ�Ϊ����Fe3+��Fe2+��Mg2+��Mn2+ת��Ϊ������ʹAl3+ת��ΪAlO2-��
(5)������Ŀ���������֪����pH=11ʱ�����н������Ӷ��Ѿ�������AlԪ����AlO2-����ʽ���ڣ�Fe2+�������Ѹ�ٱ��������ʴ�Ϊ��Fe(OH)3��Mg(OH)2��Mn(OH)2��
(6)ƫ��������Һ��ͨ�������̼�����������������������Ҳ����ܽ⣻������Ҫ©�������������ձ�����ҵ�ϵ����������ȡ�����ʣ�����ʽΪ��2Al2O3![]() 4Al+O2�����ʴ�Ϊ��CO2���ձ�����������2Al2O3
4Al+O2�����ʴ�Ϊ��CO2���ձ�����������2Al2O3![]() 4Al+O2����
4Al+O2����



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɺ����ˮ��ȡ����ص�һ�ֹ������£�

����KI(aq)��ʱ�����¶���ˮ�����ӻ�ΪKw��1.0��10��13��Ksp[Fe(OH)2]��9.0��10��15��Ϊ����0.9 mol��L��1 FeI2��Һ��Fe2+ˮ�����ɽ�״������I-����ʼ����K2CO3���뱣����Һ��pH������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ֱ��dz�����һԪ�����ǿ�ᣮ
��1��������ˮ��Һ�еĵ��뷽��ʽΪ_________________��
��2����ѧ�����������ȣ�AG����ʾ��Һ����Եĸ���涨��AG=lg![]() ��pH=3�Ĵ�����Һ��AG=_________________��
��pH=3�Ĵ�����Һ��AG=_________________��

��3����0.1molL��1NaOH��Һ�ֱ�ζ������Ϊ20.00mLŨ�Ⱦ�Ϊ0.1molL��1������ʹ�����Һ���õ��ζ���������ҺpH�����NaOH��Һ������仯�������ζ����ߡ�
��������������________________������I������II������
��V1��V2�Ĺ�ϵ��V1_________V2��������������=��������������
��M���Ӧ����Һ�У������ӵ����ʵ���Ũ���ɴ�С��˳����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����A��B��C��D��E����Ԫ�أ�����A��B��C��DΪ������Ԫ�أ�AԪ�ص�����������������ԭ��������ͬ��Bԭ�Ӻ�����3��������ͬ��ԭ�ӹ����ÿ�ֹ���еĵ�������ͬ��Cԭ�ӵļ۵��ӹ���Ϊcsccpc+1��DԪ�ص�ԭ�������������ȴ�����������2����D����������E�������ӵ��Ӳ�ṹ��ͬ��D��E���γɻ�����E2D��
(1)����Ԫ���У���һ��������С��Ԫ�ص�ԭ�ӽṹʾ��ͼΪ__��D�ļ۵����Ų�ͼΪ__��
(2)���з��ӽṹͼ�е���������ʾ����Ԫ�ص�ԭ���г�ȥ�������ӵ�ʣ�ಿ�֣�С�ڵ��ʾû���γɹ��ۼ����������ӣ����߱�ʾ���ۼ���

�������Ϸ����У�����ԭ�Ӳ���sp3�ӻ��γɻ�ѧ������__(��д���ӵĻ�ѧʽ)�� �ڢ۵ķ�������__��������__��������
(3)A��C��D���γɼȾ������Ӽ��־��й��ۼ��Ļ�����仯ѧʽ����Ϊ__��������C���⻯��ˮ��Һ��CuSO4��Һ��Ӧ���ɵ������仯ѧʽΪ__����˵���������������ԭ������λ�弰�ڽ������֮��ijɼ������__��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪(CH3)2C=CH2���ɱ�ʾΪ![]() ��������(��ͼ)������ֲ���������Ƽ������жԸ����ʵ�������ȷ���ǣ� ��
��������(��ͼ)������ֲ���������Ƽ������жԸ����ʵ�������ȷ���ǣ� ��
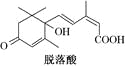
A.�����ʽΪC15H22O4
B.�����ڷ����廯����
C.1 mol������������3 mol H2������Ӧ
D.��������һ�������¿ɷ�������ȡ����Ӧ���ɺ���Ԫ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ��������һδ֪Ũ�ȵ�ϡ���ᣬijѧ��Ϊ�ⶨ�����Ũ����ʵ�����н�������ʵ�顣�������������գ�
����һ������250mL 0.1000mol/L NaOH����Һ��
�������ȡ20.00mL����ϡ���������ƿ�У����μ�2��3�η�̪��Һ��ָʾ�������Լ����Ƶı�NaOH��Һ���еζ����ظ������ζ�����2�Σ���¼�������¡�
ʵ���� | NaOH��Һ��Ũ�ȣ�mol/L�� | �ζ����ʱ������NaOH��Һ�������mL�� | ����������Һ�������mL�� |
1 | 0.1000 | 20.02 | 20.00 |
2 | 0.1000 | _______ | 20.00 |
3 | 0.1000 | 19.98 | 20.00 |
��1������һ��Ҫ�����������ƹ��������Ϊ__________g�����Ʊ���Һ��Ҫ�õ����������ձ��⣬����Ҫ�IJ���������__________________��
��2�����������ȡ20.00mL��ϡ�����õ���������__________���жϵζ��յ��������_____
��3��ʵ��2���ζ�ǰҺ������0���̶ȴ����ζ���Һ����ͼ��ʾ�������Ϊ________mL�������������ݣ��ɼ�����������Ũ��Ϊ__________��

��4��������ʵ���У����в���������������ȷ������ɲⶨ���������ҺŨ��ֵ��ƫ�ߵ�����_______��
A. ���Ʊ���Һ����ʱ�����ӿ̶���
B. ��ƿˮϴ��ֱ��װ����Һ
C. ��ʽ�ζ���ˮϴ��δ�ô���ϡ������Һ��ϴ
D. �ζ������յ�ʱ�����Ӷ����ζ��ܶ�����
E. ��ʽ�ζ��ܼ��첿�������ݣ��ζ�����ʧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͭ�������ƴ������ᡣ��CuO��Cu�����ս�Ҳ����ȡCu2O����֪��Ӧ��
��2Cu(s) + O2(g) = 2CuO(s) ��H = 314 kJ/mol
��2Cu2O(s) + O2(g) = 4CuO(s) ��H = 292 kJ/mol
��ӦCuO(s) ��Cu(s) ��Ӧ����Cu2O(s) ���Ȼ�ѧ����ʽ�ǣ� ��
A.CuO(s) + Cu(s) = Cu2O(s) ��H = 22 kJ/mol
B.CuO(s) + Cu(s) = Cu2O(s) ��H = +22 kJ/mol
C.CuO(s) + Cu(s) = Cu2O(s) ��H = 11 kJ/mol
D.CuO(s) + Cu(s) = Cu2O(s) ��H = +11 kJ/mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ظ������һ����Ҫ�Ļ���ԭ�ϣ�һ���ɸ������Ʊ������������Ҫ�ɷ�ΪFeO��Cr2O3�������й衢�������ʡ��Ʊ�������ͼ��ʾ��
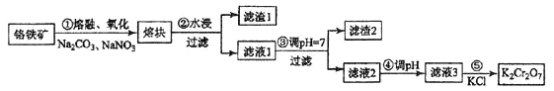
�ش��������⣺
��1������ٵ���Ҫ��ӦΪ��FeO��Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
������Ӧ��ƽ��FeO��Cr2O3��NaNO3��ϵ����Ϊ__________���ò��費��ʹ���մ�������ԭ����________________��
��2������1�к������Ľ���Ԫ����____________������2����Ҫ�ɷ���_____________���������ʡ�
��3������ܵ���Һ2��pHʹ֮��____________�����С������ԭ����___________________�������ӷ���ʽ��ʾ����
��4���й����ʵ��ܽ����ͼ��ʾ������Һ3���м�������KCl������Ũ������ȴ�ᾧ�����˵õ�K2Cr2O7���塣��ȴ��___________�����ţ��õ���K2Cr2O7�����Ʒ��ࡣ

a��80�� b��60�� c��40�� d��10��
����ݵķ�Ӧ������___________________��
��5��ij������m1 kg ������ۣ���Cr2O3 40%���Ʊ�K2Cr2O7�����յõ���Ʒ m2 kg������Ϊ_____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£�һ�̶�������ܱ������з�����Ӧ��A(s)+3B(g)![]() 2C(g)+D(g)�����������в���˵���÷�Ӧ����ƽ��״̬����
2C(g)+D(g)�����������в���˵���÷�Ӧ����ƽ��״̬����
�ٻ�������ѹǿ���ٱ仯
�ڵ�λʱ��������2a mol C��ͬʱ����3a mol B
�������ܶȲ��ٱ仯
��A���������ٱ仯
�������ƽ����Է����������ٱ仯
��2v��(C)=3v��(B)
A.�٢�B.�ڢ�C.�٢�D.�ܢ�
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com