
【题目】已知:2NO2 ![]() N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )
N2O4 △H<0,CaO溶于水放热,NH4Cl晶体溶于水吸热.在3个体积相等的圆底烧瓶中充满等量的NO2气体,并分别放置在加有下列物质的烧杯(烧杯内有水)中:(1)中加入CaO,(2)中加入NH4Cl晶体,(3)中不加任何其它物质,如图所示.下列叙述正确的是( )

A.(1)中红棕色变深,(2)中红棕色变浅
B.(1)中红棕色变浅,(2)中红棕色变深
C.烧瓶(1)中气体的压强不变
D.烧瓶(2)中气体的压强增大
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案科目:高中化学 来源: 题型:
【题目】在1200 ℃时,天然气脱硫工艺中会发生下列反应:H2S(g)+![]() O2(g)= SO2(g)+H2O(g) ΔH1,H2S(g)+
O2(g)= SO2(g)+H2O(g) ΔH1,H2S(g)+![]() O2(g)= S(g)+H2O(g) ΔH2,2H2S(g)+SO2(g)=
O2(g)= S(g)+H2O(g) ΔH2,2H2S(g)+SO2(g)= ![]() S2(g)+2H2O(g) ΔH3,2S(g)= S2(g) ΔH4 ,则ΔH4的正确表达式为( )
S2(g)+2H2O(g) ΔH3,2S(g)= S2(g) ΔH4 ,则ΔH4的正确表达式为( )
A.ΔH4=![]() (ΔH1+ΔH3-3ΔH2)B.ΔH4=
(ΔH1+ΔH3-3ΔH2)B.ΔH4=![]() (3ΔH2-ΔH1-ΔH3)
(3ΔH2-ΔH1-ΔH3)
C.ΔH4=![]() (ΔH1+ΔH3-3ΔH2)D.ΔH4=
(ΔH1+ΔH3-3ΔH2)D.ΔH4=![]() (ΔH1-ΔH3-3ΔH2)
(ΔH1-ΔH3-3ΔH2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由含碘废水制取碘酸钾的一种工艺如下:

“制KI(aq)”时,该温度下水的离子积为Kw=1.0×10-13,Ksp[Fe(OH)2]=9.0×10-15。为避免0.9 mol·L-1 FeI2溶液中Fe2+水解生成胶状物吸附I-,起始加入K2CO3必须保持溶液的pH不大于______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是典型的可充型电池,请回答下列问题(不考虑氢、氧的氧化还原):放电时,正极的电极反应式是____________;电解液中H2SO4的浓度将_______(填变小、变大或不变);当外电路通过0.5 mol电子时,理论上负极板的质量增加__________g。
(2)用甲醇燃料电池电解AgNO3溶液,如图所示,回答下列问题:
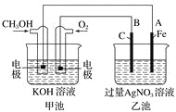
①甲池是________装置;通入CH3OH的电极名称是______,
②写出通入O2的电极的电极反应式是________________。
③A电极的电极反应式为_________________________。
④当乙池中A(Fe)极的质量增加2.70 g时,甲池中理论上消耗O2_____mL(标准状况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中不正确的是
A. 正戊烷、新戊烷、异戊烷互为同分异构体
B. 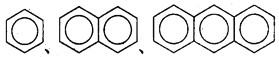 互为同系物
互为同系物
C. 四氯乙烯分子中所有原子都处于同一平面
D. 扁桃酸(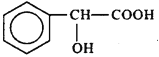 )属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种
)属于甲酸酯且有羟基直接连在苯环上的同分异构体共有13种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知二氧化硅,二氧化硫和二氧化碳都是酸性氧化物,化学性质具有一定的相似性,镁和钠的化学性质也具有一定的相似性.
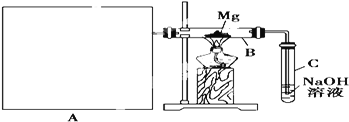
Ⅰ![]() 用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
用如上图所示装置进行镁和二氧化硫的实验,其中A是制备二氧化硫的发生装置。
(1)选择制取二氧化硫的合适试剂_____________________________![]() 填序号
填序号![]() 。
。
①![]() 的硫酸溶液②
的硫酸溶液②![]() 硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
硫酸溶液③亚硫酸钠固体④亚硫酸钙固体
(2)写出装置B中发生置换反应的化学方程式:_____________________________装置C中氢氧化钠溶液的作用是_____________________________
(3)请在图中画出制备二氧化硫的发生装置,注明仪器名称,固定仪器省略不画。_______________
(4)你认为该装置的不足之处____________________________________________________![]() 任写2条
任写2条![]()
Ⅱ![]() 某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
某研究性学习小组进行了“实验室制硅”的研究,查阅资料知:①工业上在高温时用碳还原二氧化硅可制得硅;②镁在点燃的条件下即可与二氧化硅反应;③金属硅化物与稀硫酸反应生成硫酸盐与四氢化硅;④四氢化硅在空气中自燃.
他们在实验报告中记录着:“![]() 选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量
选用合适的物质在适宜的条件下充分反应,再用足量稀硫酸溶解固体产物;然后过滤,洗涤,干燥,最后称量![]() 在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的
在用稀硫酸溶解固体产物时,发现有爆鸣声和火花,其产率也只有预期值的![]() 左右.”
左右.”
(5)该小组“实验室制硅”的化学方程式是_____________________________
(6)你估计“用稀硫酸溶解固体产物时,发现有爆鸣声和火花:的原因是_____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸和盐酸分别是常见的一元弱酸和强酸.
(1)醋酸在水溶液中的电离方程式为_________________。
(2)科学家提出了用酸度(AG)表示溶液酸碱性的概念,规定:AG=lg![]() 则pH=3的醋酸溶液的AG=_________________。
则pH=3的醋酸溶液的AG=_________________。

(3)用0.1molL﹣1NaOH溶液分别滴定体积均为20.00mL浓度均为0.1molL﹣1的盐酸和醋酸溶液,得到滴定过程中溶液pH随加入NaOH溶液体积而变化的两条滴定曲线。
①滴定醋酸的曲线是________________(填“I”或“II”)。
②V1和V2的关系:V1_________V2(填“>”、“=”或“<”)。
③M点对应的溶液中,各离子的物质的量浓度由大到小的顺序是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A,B,C,D,E五种元素,其中A,B,C,D为短周期元素,A元素的周期数、主族数、原子序数相同;B原子核外有3种能量不同的原子轨道且每种轨道中的电子数相同;C原子的价电子构型为csccpc+1,D元素的原子最外层电子数比次外层电子数少2个,D的阴离子与E的阳离子电子层结构相同,D和E可形成化合物E2D.
(1)上述元素中,第一电离能最小的元素的原子结构示意图为__;D的价电子排布图为__;
(2)下列分子结构图中的●和○表示上述元素的原子中除去最外层电子的剩余部分,小黑点表示没有形成共价键的最外层电子,短线表示共价键.

则在以上分子中,中心原子采用sp3杂化形成化学键的是__(填写分子的化学式); 在③的分子中有__个σ键和__个π键.
(3)A,C,D可形成既具有离子键又具有共价键的化合物,其化学式可能为__;足量的C的氢化物水溶液与CuSO4溶液反应生成的配合物,其化学式为__,请说出该配合物中中心原子与配位体及内界与外界之间的成键情况:__.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】重铬酸钾是一种重要的化工原料,一般由铬铁矿制备,铬铁矿的主要成分为FeO·Cr2O3,还含有硅、铝等杂质。制备流程如图所示:
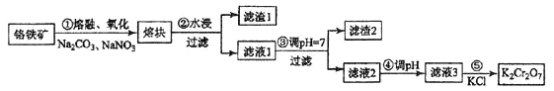
回答下列问题:
(1)步骤①的主要反应为:FeO·Cr2O3+Na2CO3+NaNO3![]() Na2CrO4+ Fe2O3+CO2+ NaNO2
Na2CrO4+ Fe2O3+CO2+ NaNO2
上述反应配平后FeO·Cr2O3与NaNO3的系数比为__________。该步骤不能使用陶瓷容器,原因是________________。
(2)滤渣1中含量最多的金属元素是____________,滤渣2的主要成分是_____________及含硅杂质。
(3)步骤④调滤液2的pH使之变____________(填“大”或“小”),原因是___________________(用离子方程式表示)。
(4)有关物质的溶解度如图所示。向“滤液3”中加入适量KCl,蒸发浓缩,冷却结晶,过滤得到K2Cr2O7固体。冷却到___________(填标号)得到的K2Cr2O7固体产品最多。

a.80℃ b.60℃ c.40℃ d.10℃
步骤⑤的反应类型是___________________。
(5)某工厂用m1 kg 铬铁矿粉(含Cr2O3 40%)制备K2Cr2O7,最终得到产品 m2 kg,产率为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com