
����Ŀ��������ѧ֪ʶ���
��1���ڶ�����Ԫ���У���һ�����ܽ���B��O֮���Ԫ���� ��
��2��N��O���������NO2+ �� ���ĵ���ʽΪ �� ��ȵ�������������2�֣���
��3��Ԫ�ؽ�Au���������ڱ��еĵ������ڣ���Cuͬ�壬Auԭ����Χ�����Ų�ʽΪ��
��4��ij�л���ṹ��ͼ��ʾ��������е�ԭ�ӳ�H��������sp3�ӻ���2mol�÷��Ӻ��Цм�����ĿΪ 
��5����֪Ti3+���γ���λ��Ϊ6���������к��ѵ�������ɫ�ľ��壬һ��Ϊ��ɫ����һ��Ϊ��ɫ�������ʵ��֤�������־������ɽ�ΪTiCl36H2O��Ϊ�ⶨ�����־��廯ѧʽ�����������ʵ�飺
a���ֱ�ȡ����������������ᄃ�����Ʒ��ɴ�����Һ��
b���ֱ���������Һ�е���AgNO3��Һ����������ɫ������
c��������ȫ��ֱ���˵����ݳ�������ϴ�Ӹ���������������ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ��������Ϊ��ɫ�����ˮ��Һ��Ӧ�õ�����������1.5��������ɫ���������Ļ�ѧʽΪ �� ����ʾ���ڽ����磩
���𰸡�
��1��Be��C
��2��![]() ��N2O��CO2
��N2O��CO2
��3��5d106s1
��4��5��12NA
��5��[Ti��H2O��5Cl]Cl2?H2O
���������⣺��1��ͬ���ڣ��������ҵ�һ������������ڶ�����Ԫ���У���һ�����ܽ���B��O֮���Ԫ����Be��C�����Դ��ǣ�Be��C��
��2.��N��O���������NO2+ �� ��CO2��Ϊ�ȵ����壬�ṹ���ƣ������ʽΪ ![]() ���ȵ����廹��N2O��SCN����OCN����CNO����CS2��BeCl2�ȣ����Դ��ǣ�
���ȵ����廹��N2O��SCN����OCN����CNO����CS2��BeCl2�ȣ����Դ��ǣ� ![]() ��N2O��CO2��
��N2O��CO2��
��3.����Au���������ڱ��еĵ������ڣ���Cuͬ�壬ΪIB��Ԫ�أ�Auԭ����Χ�����Ų�ʽΪ5d106s1 �� ���Դ��ǣ�5d106s1��
��4.��2������C��������N����OH��O��������״���ĵ�CΪsp3�ӻ�������5��ԭ����sp3�ӻ���˫������1���м�����2mol�÷��Ӻ��Цм�����ĿΪ12NA �� ���Դ��ǣ�5��12NA��
��5.����������е���ԭ���Dz��������ƶ��ģ����������п����γ������ӣ������ӿ����������ӷ�Ӧ�����Ȼ�����ɫ������������ɫ�����ˮ��Һ��AgNO3��Һ��Ӧ�õ��İ�ɫ��������Ϊ��ɫ�����ˮ��Һ��Ӧ�õ�����������1.5����˵����ɫ�����������������ƶ��������ӣ�����ɫ������ֻ��2�������ƶ������ӣ�����һ����ԭ���γ���������Ϊ��Ϊ6��λ������������������ˮ������ѧʽΪ[TiCl��H2O��5]Cl2H2O������ɫ����Ļ�ѧʽΪ[Ti��H2O��6]Cl3 �� ���Դ��ǣ�[Ti��H2O��5 Cl]Cl2H2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ϸ����������Ҫ�л���A��E��Ԫ����ɼ����ϵͼ�����ͼ�ش�

(1)ͼ�Т���ָԪ��Ϊ________ ��
(2)D����ˮ��IJ�����________________��
(3)E���ж����ԣ���b����������_______________________________________����b��ƽ����Է�������Ϊr��ͨ���ܷ�Ӧ�����γ�m���������������۵�������Է�������Ϊe��E����E�������ļ�����Ŀ��____________________________��
(4)Ⱦɫ����__________����Ҫ���壬��Ҫ�ֲ���ϸ�������_______Ⱦɫ������ǻ��Ƥϸ��Ⱦɫ�����������¹۲쵽ϸ���˳���ɫ��
(5)�����е���Ҫ�ɷ��ǵ����ʣ��ڼ�����Һ�У���������CuSO4��Ӧ�ܲ�����ɫ���ʣ����ǵ�������˫�����Լ��ķ�Ӧ���������һ��Ӧ�������������в��ϣ����һ��ʵ����֤���˵���Һ����ø�ǵ����ʡ�
��ѡ���ϣ�����Ũ��Ϊ0.1 g/mL��NaOH��Һ������Ũ��Ϊ0.01 g/mL��CuSO4��Һ������Ũ��Ϊ0.05 g/mL��CuSO4��Һ�������Ե�����Һ��ϡ�͵���Һ����Һ������ˮ���Թܡ��ιܡ���������������ѡ��
ʵ�鲽�裺
��ȡ3֧�Թܣ����Ϊ1��2��3��
��__________________________________________________ ��
��____________________________________________________ ��
��____________________________________________________ ��
ʵ����Ԥ�⣺
______________________ ��
ʵ�������������ڵ������Ҫ�ɷ���ˮ�͵����ʣ���Һ����Ҫ�ɷ���ˮ����Һ����ø����ˣ�ʵ��������֤�� __________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�˵��������ȷ����

A. ��ͼ���ֻ������С�0����A����Ӧ����Ľ�����һ���Ǵ����
B. ����ϸ�����ں��м�ͼ�е����ֻ�����
C. ����ͼ��ʾij��ø�ڲ�ͬ�¶��´�ij��Ӧ��Ч��ͼ�����¶�a>b>c
D. ����ͼ��ʾ��ͬŨ�ȵ�ij��ø��ij��Ӧ��Ч��ͼ����øŨ��a>b>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�߷��ӻ�����R�Ľṹ��ʽΪ��  �������й�R��˵����ȷ���ǣ� ��
�������й�R��˵����ȷ���ǣ� ��
A.R�ĵ���֮һ�ķ���ʽΪC9H10O2
B.R��ȫˮ����������ΪС�����л���
C.ͨ���Ӿ۷�Ӧ�����۷�Ӧ��������R
D.���������£�1 mol R��ȫˮ������NaOH�����ʵ���Ϊ2 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�Ϊ4�ֳ�����Һ�����ʵ��������������ʵ���Ũ�ȣ�
���� | HCl | NaOH | CH3COOH | HNO3 |
���ʵ���������/% | 36.5 | 40 | 60 | 63 |
���ʵ���Ũ��/mol��L1 | 11.8 | 14.3 | 10.6 | 13.8 |
��4����Һ���ܶ���С����
A��HCl B��NaOH
C��CH3COOH D��HNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������100mL 1.0mol/L Na2CO3��Һ����ȷ�ķ����ǣ� �� �ٽ�10.6g Na2CO3����100mLˮ��
�ڽ�28.6g Na2CO310H2O��������ˮ�У�����ˮϡ����100mL
�۽�20ml 5.0mol/L Na2CO3��Һ��ˮϡ����100mL��
A.�٢�
B.�ڢ�
C.ֻ�Т�
D.ֻ�Т�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������0.1mol/L Na2CO3��Һ������������ǣ� ��
A.0.5 L����Һ�������ӵ����ʵ���Ũ��Ϊ0.2 mol/L
B.1 L����Һ�к���Na2CO3������Ϊ10.6 g
C.��1 L����Һ��ȡ��100 mL����ȡ����Һ��Na2CO3�����ʵ���Ũ��Ϊ0.01 mol/L
D.ȡ����Һ10 mL����ˮϡ����100 mL��Na2CO3�����ʵ���Ũ��Ϊ0.01 mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��FeCO3��ɰ�ǻ��ÿ�������Ѫ����ʵ�������Ʊ�FeCO3��������ͼ��ʾ������˵��������ǣ� �� 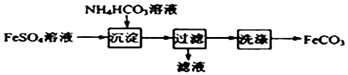
A.��ƷFeCO3�ڿ����и��·ֽ�ɵõ�������FeO
B.������KSCN��Һ����FeSO4��Һ�Ƿ����
C.������������CO2����ų�
D.��������Ƿ�ϴ�Ӹɾ����������ữ��BaCl2��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±�ΪԪ�����ڱ���һ���֣������г���11��Ԫ�������ڱ��е�λ�ã���Ҫ��������и�С�⣮
���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 |
2 | �� | �� | �� | |||||
3 | �� | �� | �� | �� | �� | |||
4 | �� | �� |
��1����ѧ��������õ�Ԫ��������Ԫ�ط��ţ�����ԭ�ӽṹʾ��ͼΪ ��
��2��Ԫ�آ������Ϊ��������������ˮ����Ļ�ѧʽΪ ��
��3��Ԫ�آ���Ԫ�آ��γɻ�����ĵ���ʽΪ ��
��4���ǽ�������ǿ��Ԫ��������Ԫ�ط��ţ�����0����ԭ�Ӱ뾶����Ԫ��������Ԫ�ط��ţ���Ԫ�آٵ�����ˮ��Ӧ�����ӷ���ʽ�� ��
��5���١��ۡ�������Ԫ�ص����������ˮ�����У�������ǿ�Ļ�����Ļ�ѧʽ�� ��
��6�����γ��������������Ԫ��������Ԫ�ط��ű�ʾ����д����Ԫ�صĵ�����ٵ�����������ˮ���ﷴӦ�Ļ�ѧ����ʽ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com