
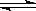 CO��g����H2O��g����
CO��g����H2O��g����| t�� | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 ��2������ ��3��b��c ��4��830
��2������ ��3��b��c ��4��830


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
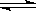 2HI(g)�� H��0,���ﵽƽ��,HI�����������(HI)��ʱ��仯��ͼ������ʾ�����ı䷴Ӧ������ ��(HI)�ı仯������ͼ������ʾ����ı������������
2HI(g)�� H��0,���ﵽƽ��,HI�����������(HI)��ʱ��仯��ͼ������ʾ�����ı䷴Ӧ������ ��(HI)�ı仯������ͼ������ʾ����ı������������ 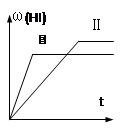
| A�����º��������£������ʵ����� |
| B�����������£���С��Ӧ������� |
| C�����������������¶� |
| D�����������£�����Ӧ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 CO2(g) ��H2 (g)����2 L�ܱ�������ͨ��2 mol CO (g)��1 mol H2O (g)��2 min��Ӧ�ﵽƽ��ʱ�����CO�����ʵ���Ϊ1.6mol����H2O (g)��ʾ�÷�Ӧ����Ϊ________���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ________�����������ټ���2 mol CO (g)�������´ﵽƽ��ʱ��CO��ת����________20%(�>������<������)��
CO2(g) ��H2 (g)����2 L�ܱ�������ͨ��2 mol CO (g)��1 mol H2O (g)��2 min��Ӧ�ﵽƽ��ʱ�����CO�����ʵ���Ϊ1.6mol����H2O (g)��ʾ�÷�Ӧ����Ϊ________���¶��£��÷�Ӧ��ƽ�ⳣ��Ϊ________�����������ټ���2 mol CO (g)�������´ﵽƽ��ʱ��CO��ת����________20%(�>������<������)�� 2NO��O2 ��H>0����Ӧ������NO2��Ũ����ʱ��仯���������ͼ��ʾ��
2NO��O2 ��H>0����Ӧ������NO2��Ũ����ʱ��仯���������ͼ��ʾ��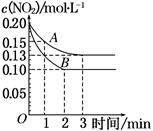
 4NO2(g)��O2(g)
4NO2(g)��O2(g) 2NO(g)��O2(g)
2NO(g)��O2(g)�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 p C��ij�¶��´ﵽƽ�⡣
p C��ij�¶��´ﵽƽ�⡣�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 2Z��g�����˷�Ӧ�ﵽƽ��ı�־�� ( )
2Z��g�����˷�Ӧ�ﵽƽ��ı�־�� ( )| A������������ƽ��Ħ���������� | B�������ڸ����ʵ�Ũ����� |
| C��������X��Y��Z��Ũ��֮��Ϊ1�U2�U2 | D����λʱ������0.1mol Xͬʱ����0.2mol Z |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 H2(g) + CO(g)�� ��H =" +131.3" kJ��mol��1����S =" +133.7" J��mol��1��K��1
H2(g) + CO(g)�� ��H =" +131.3" kJ��mol��1����S =" +133.7" J��mol��1��K��1 2NH3(g)��K=0.5,
2NH3(g)��K=0.5, N2 (g)+ 3H2(g)��K= ������ֵ����
N2 (g)+ 3H2(g)��K= ������ֵ����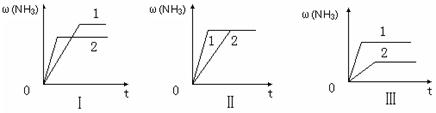
| A��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P2��P1 |
| B��ͼ������Dz�ͬѹǿ�Է�Ӧ��Ӱ�죬��P1��P2 |
| C��ͼ������Dz�ͬ�¶ȶԷ�Ӧ��Ӱ�죬��T1��T2 |
| D��ͼ�������ͬ��ͬѹ�£��������ܣ�1��2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ���ѡ��
 CO2(aq) ��H=-19.75kJ��mol-��Ϊ�˼�С����ЧӦ�IJ��������������̼������ˮ�е��ܽ�ȣ�Ӧ��ȡ�ķ�����
CO2(aq) ��H=-19.75kJ��mol-��Ϊ�˼�С����ЧӦ�IJ��������������̼������ˮ�е��ܽ�ȣ�Ӧ��ȡ�ķ�����| A��������ѹ | B�����¼�ѹ | C�����¼�ѹ | D��������ѹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ������ ���ͣ������
 pZ(g)+qQ(g),ʽ��m��n��p��qΪ����ϵ������0 min��3 min �ڣ����������ʵ����ı仯���±���ʾ��
pZ(g)+qQ(g),ʽ��m��n��p��qΪ����ϵ������0 min��3 min �ڣ����������ʵ����ı仯���±���ʾ��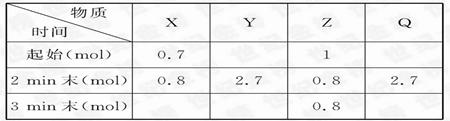
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com