
| m |
| M |
| 4.6g |
| 23g/mol |
| 0.2mol×2 |
| 2 |
| 0.2mol×1 |
| 2 |


科目:高中化学 来源: 题型:
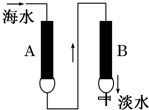 海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )
海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )| A、HR与镁离子的反应可表示为:2HR+Mg2+═MgR2+2H+ |
| B、ROH与氯离子的反应可表示为:ROH+Cl-═RCl+OH- |
| C、A为氢型离子交换树脂(HR),B为羟型离子交换树脂(ROH) |
| D、A为羟型离子交换树脂(ROH),B为氢型离子交换树脂(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 | 40℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
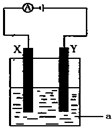 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com