
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 | 40℃ |

| 1mol-0.5mol |
| 2L |
| 0.25mol/L |
| t1min |
| 1 |
| 4t1 |
| 1 |
| 4t1 |
| 1 |
| 2t1 |
| 1 |
| 2t1 |
| 2.25mol |
| 3mol |
| 2 |
| 3 |


科目:高中化学 来源: 题型:
| A、①② | B、②③ | C、①③ | D、①②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
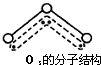 ,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:
,呈V型,键角116.5℃.三个原子以一个O原子为中心,与另外两个O原子分别构成一个非极性共价键;中间O原子提供2个电子,旁边两个O原子各提供1个电子,构成一个特殊的化学键--三个O原子均等地享有这4个电子.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
 有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH
有机化学中有如下的转化关系:C2H4→CH3CH2OH→CH3CHO→CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:
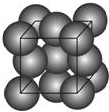 金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.
金晶体的最小重复单元(也称晶胞)是面心立方体,即在立方体的8个顶点各有一个金原子,各个面的中心有一个金原子,每个金原子被相邻的晶胞所共有(如图).金原子的直径为d,用N 表示阿伏加德罗常数,M表示金的摩尔质量.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com