
| A、①② | B、②③ | C、①③ | D、①②③ |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
| A、在金属元素与非金属元素的分界线附近可以寻找制备半导体材料的元素 |
| B、在过渡元素中可以寻找制备催化剂及耐高温和耐腐蚀的元素 |
| C、所有的族都是由金属元素和非金属元素共同组成的 |
| D、现有元素周期表包括18个纵列,共16个族 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下1mol 水和22.4L CO2 |
| B、标准状况下2gH2和22.4L溴 |
| C、0.1mol HCl和2.24L He |
| D、28g CO和6.02×1023个CO分子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
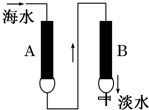 海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )
海水的一种淡化方法是使海水(含钠离子、镁离子、氯离子、硫酸根等)依次通过两种离子交换树脂A、B(如图所示),而得到淡化.已知氢型离子交换树脂(HR)可对阳离子进行交换,而羟型离子交换树脂(ROH)可对阴离子进行交换,试分析下列叙述中不正确的是( )| A、HR与镁离子的反应可表示为:2HR+Mg2+═MgR2+2H+ |
| B、ROH与氯离子的反应可表示为:ROH+Cl-═RCl+OH- |
| C、A为氢型离子交换树脂(HR),B为羟型离子交换树脂(ROH) |
| D、A为羟型离子交换树脂(ROH),B为氢型离子交换树脂(HR) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1mol氧 |
| B、1mol任何物质的质量都等于该物质的相对分子质量 |
| C、1molHCl气体的体积等于22.4L |
| D、氧气的摩尔质量为32g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 | 40℃ |

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com