


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案科目:高中化学 来源: 题型:
| 反应物 | 催化剂 | 温度 | |
| ① | 10mL10% H2O2溶液 | 无 | 25℃ |
| ② | 10mL20% H2O2溶液 | 无 | 25℃ |
| ③ | 10mL20% H2O2溶液 | 无 | 40℃ |
| ④ | 10mL20% H2O2溶液 | 1mL0.1mol?L-1FeCl3溶液 | 40℃ |

查看答案和解析>>
科目:高中化学 来源: 题型:
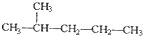 和
和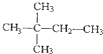 ②
② 和
和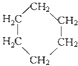
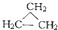 ④C2H6和
④C2H6和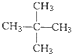 ⑤
⑤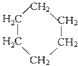 和
和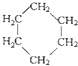
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
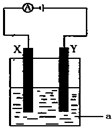 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NCl5 |
| B、NCl4 |
| C、NCl3 |
| D、NCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、丁达尔效应可以区分溶液和胶体 |
| B、一种分散系里只能有一种分散质 |
| C、以水为分散剂的分散系,按稳定性由弱至强的顺序是:浊液?胶体?溶液 |
| D、分散系中分散质粒子直径由大到小的顺序是:浊液?胶体?溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、BaSO3(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H>0 |
| B、H2的热值为142.9kJ?g-1,则氢气燃烧的热化学方程式可表示为2H2(g)+O2(g)═2H2O(l)△H=-285.8kJ?mol-1 |
| C、增大反应物浓度,可增大单位体积内活化分子百分数,从而增加有效碰撞的次数 |
| D、0.1mol?L-1Na2CO3溶液在35℃时碱性比25℃强,说明盐类水解反应是放热反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com