
【题目】一定温度下,某容器中加入足量碳酸钙,发生反应CaCO3(s) ![]() CaO(s)+CO2(g)达到平衡,下列说法正确的是
CaO(s)+CO2(g)达到平衡,下列说法正确的是
A.将体积缩小为原来的一半,当体系再次达到平衡时,CO2的浓度为原来的2倍
B.CaCO3(s)加热分解生成CaO(s)和CO2,△s<0
C.将体积增大为原来的2倍,再次达到平衡时,气体密度不变
D.保持容器体积不变,充入He,平衡向逆反应方向进行
【答案】C
【解析】
试题分析:A.将体积缩小为原来的一半,当体系再次达到平衡时,若平衡不移动,C02的浓度为原来的2倍,由于压强增大,平衡向着逆向移动,则平衡时二氧化碳的浓度小于原先的2倍,故A错误;B.CaCO3(s)高温分解为CaO(s)和CO2(g),反应方程式为:CaCO3(s)![]() CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,则△S>0,故B错误;C.该反应中只有二氧化碳气体,所以反应过程中气体的密度始终不变,则将体积增大为原来的2倍,再次达到平衡时,气体密度不变,故C正确;D.保持容器体积不变,充入He,由于气体的浓度不变,则平衡不会移动,故D错误;故选C。
CaO(s)+CO2(g),反应生成气体,是熵值增加的过程,则△S>0,故B错误;C.该反应中只有二氧化碳气体,所以反应过程中气体的密度始终不变,则将体积增大为原来的2倍,再次达到平衡时,气体密度不变,故C正确;D.保持容器体积不变,充入He,由于气体的浓度不变,则平衡不会移动,故D错误;故选C。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1 mol H2O的质量为18 g/mol
B. 3.01×1023个SO2分子的质量为32 g
C. 4 g NaOH溶于1L水中,所得溶液的物质的量浓度为0.1 mol/L
D. 标准状况下,1 mol任何物质体积均为22.4 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关节炎首次发作一般在寒冷季节,原因是关节滑液中形成了尿酸钠晶体(NaUr),易诱发关节疼痛,其化学机理是:①HUr(aq)+H2O(1)![]() Ur-(aq)+H3O+(aq)
Ur-(aq)+H3O+(aq)
② Ur-(aq)+Na+(aq)![]() NaUr(s) △H
NaUr(s) △H
下列叙述错误的是
A. 降低温度,反应②平衡正向移动
B. 反应②正方向是吸热反应
C. 降低关节滑液中HUr及Na+含量是治疗方法之一
D. 关节保暖可以缓解疼痛,原理是平衡②逆向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】生产钡盐的主要原料是重晶石(BaSO4)。在高温下,重晶石与石墨存在如下反应:
①: BaSO4(s)+4C(s,石墨) ![]() 4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
4CO(g)+BaS(s) ΔH1=+571.2 kJ/mol
②: BaSO4(s)+4CO(g) ![]() 4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
4CO2(g)+BaS(s) ΔH2 =-118.8 kJ/mol
回答下列问题:
(1)反应①在一定条件下能够自发的原因:_______________;
(2)已知:C(s,石墨)+O2(g) = CO2(g) ΔH3 =-393.5 kJ/mol;
求 CO 的标准燃烧热ΔH4 = _______kJ/mol;
(3)图 1 为 1200K下, 恒容密闭容器中重晶石与石墨反应时, c(CO)随时间变化曲线图。 请分析图 1 曲线 c(CO)在 0-t2 区间变化的原因:_________________;
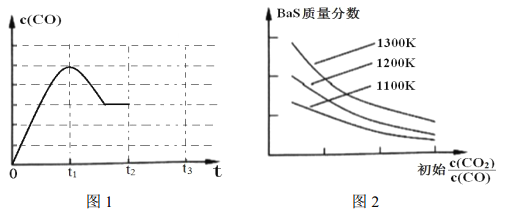
(4)图2为实验测得不同温度下, 反应体系中初始浓度比![]() 与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
与固体中BaS质量分数的关系曲线。 分析图2 曲线, 下列说法正确的有________;
A.提高 BaSO4 的投料量,可提高 BaS 的产率
B.恒温恒容时, 当混合气体的密度不变, 反应①、②均达到化学平衡状态
C.减小初始浓度比![]() ,有利于增大 BaSO4 的转化率
,有利于增大 BaSO4 的转化率
D.适当升高温度,反应②的平衡左移,对生成 BaS不利
(5)图1 中, t2 时刻将容器体积减小为一半, t3 时刻达到新的平衡, 请在图 1 中画出 t2-t3 区间 c(CO)的变化曲线。________________
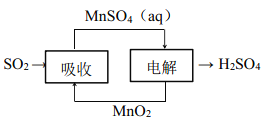
(6)工业生产中产生的 SO2 废气可用如图方法获得H2SO4。写出电解的阳极反应式_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定某盐A(仅含三种元素)的组成,某研究小组按如图流程进行了探究:

请回答:
(1)A的化学式为______________________。
(2)固体C与稀盐酸反应的离子方程式是________________________。
(3)A加热条件下分解的化学方程式为________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对如图所示的实验室制取氨气,下列说法正确的是

A.发生装置与用 KClO3 制取O2 的装置相同
B.可以用碱石灰或无水氯化钙干燥制得的氨气
C.可用单孔橡皮塞代替棉花
D.所用的铵盐不能是 NH4NO3,所用的碱可以是 NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代青铜器工艺精湛,有很高的艺术价值和历史价值,但出土的青铜器易受到环境腐蚀,所以对其进行修复和防护具有重要意义。
(1)采用“局部封闭法”可以防止青铜器进一步被腐蚀。如将糊状Ag2O涂在被腐蚀部位,Ag2O与有害组分CuCl发生复分解反应,该化学方程式为_________________________________________________。
(2)下图为青铜器在潮湿环境中发生的电化学腐蚀的示意图。

①腐蚀过程中,负极是_____(填“a”“b”或“c”);
②环境中的Cl-扩散到孔口,并与正极反应产物和负极反应产物作用生成多孔铜锈Cu2(OH)3Cl,其离子方程式为_______________;
③若生成4.29 g Cu2(OH)3Cl,则理论上耗氧体积为______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、Q、Y和Z为短周期元素,它们在周期表中的位置如图所示,这4种元素的原子最外 层电子数之和为21。下列说法不正确的是

A. Q的原子半径比Y的大
B. Z的氧化物的水化物的酸性比WW的强
C. Y的氢化物可能具有强氧化性
D. Q与W或Y形成的化学键类型相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室安卡因(G)是一种抗心率天常药物,可由下列路线合成;

(1)已知A是![]() 的单体,则A中含有的官能团是______(写名称)。B的结构简式是______。
的单体,则A中含有的官能团是______(写名称)。B的结构简式是______。
(2)C的名称(系统命名)是______,C与足量NaOH醇溶液共热时反应的化学方程式是________。
(3)X是E的同分异构体,X分子中含有苯环,且苯环上一氯代物只有两种,则X所有可能的结构简式有![]() 、_______、_______、_______。
、_______、_______、_______。
(4)F→G的反应类型是_______。
(5)下列关于室安卡因(G)的说法正确的是_______。
a.能发生加成反应 b.能使酸性高锰酸钾溶液褪色
c.能与盐酸反应生成盐 d..属于氨基酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com