
设NA为阿伏加德罗常数的值,下列法说中正确的是( )
A.25 ℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2 NA
B.标准状况下,2.24 L Cl2与足量的H2O反应,转移的电子总数为0.1 NA
C.标准状况下,22.4 L甲醇(CH3OH)中含有的氧原子数为1.0 NA
D.4.6 g Na在空气中完全反应生成Na2O、Na2O2,转移0.2 NA个电子
科目:高中化学 来源:2013-2014学年高考化学二轮复习 专题11有机化学基础练习卷(解析版) 题型:填空题
钯(Pd)催化偶联反应是近年来有机合成的研究热点之一。例如:

化合物Ⅰ可由以下合成路线获得:

(1)化合物Ⅰ与Br2发生加成反应所得产物的结构简式为______________。
(2)化合物Ⅱ的分子式为________。
(3)化合物Ⅲ与化合物Ⅱ在酸催化下发生酯化反应的化学方程式为_____________________________________________________ (注明条件)。
(4)化合物Ⅳ的结构简式为______________。
(5)Ⅴ是化合物Ⅱ的同分异构体。Ⅴ的分子中苯环上有三个取代基,能发生银镜反应,且苯环上的一氯代物有2种。Ⅴ的结构简式可能是______________。
(6)1分子 与1分子
与1分子 在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为________________。
在一定条件下可发生类似反应①的反应,生成有机化合物Ⅵ,Ⅵ的结构简式为________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺非选择题增分专练 基本概念、基本理论练习卷(解析版) 题型:填空题
为了提高资源利用率,减少环境污染,化工集团将钛厂、氯碱厂和甲醇厂组成产业链,如图所示。
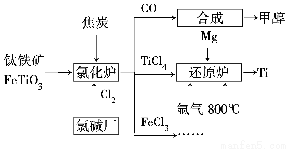
请填写下列空白。
(1)钛铁矿进入氯化炉前通常采取洗涤、粉碎、烘干、预热等物理方法处理,请从原理上解释粉碎的作用:_______________________________________
已知氯化炉中氯气和焦炭的理论用料物质的量之比为7∶6,则氯化炉中还原剂的化学式是___________________________。
(2)已知:①Mg(s)+Cl2(g)=MgCl2(s)ΔH=-641 kJ/mol
②2Mg(s)+TiCl4(s)= 2MgCl(s)+Ti(s)ΔH=-512 kJ/mol
则Ti(s)+2Cl2(g)=TiCl4(s) ΔH=________。
(3)氩气通入还原炉中并不参与反应,通入氩气的作用是___________________________
(4)以甲醇、空气、氢氧化钾溶液为原料,石墨为电极可构成燃料电池。已知该燃料电池的总反应式为2CH3OH+3O2+4OH-=2CO32—+6H2O,该电池中正极上的电极反应式为_________________________________________。
工作一段时间后,测得溶液的pH________(填“减小”、“增大”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
温度为T℃时,向V L的密闭容器中充入一定量的A和B,发生的反应为A(g)+B(g) C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
C(s)+xD(g) ΔH>0,容器中A、B、D的物质的量浓度随时间的变化如表所示。下列说法不正确的是( )
时间 | 0 | 5 min | 10 min | 15 min | 20 min | 25 min | 30 min |
A的物质的量浓度(mol·L-1) | 3.5 | 2.3 | 2.0 | 2.0 | 2.8 | 3.0 | 3.0 |
B的物质的量浓度(mol·L-1) | 2.5 | 1.3 | 1.0 | 1.0 | 1.8 | 2.0 | 2.0 |
D的物质的量浓度(mol·L-1) | 0 | 2.4 | 3.0 | 3.0 | 1.4 | 1.0 | 1.0 |
A.前10 min的平均反应速率v(D)=0.3 mol·L-1·min-1
B.该反应的平衡常数表达式为K=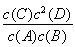
C.若达到平衡时保持温度不变,压缩容器体积,平衡不移动
D.反应至15 min时,改变的条件可以是降低温度
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮冲刺选择题限时提速专练 定量分析练习卷(解析版) 题型:选择题
相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器 编号 | 起始时各物质的物质的量/mol | 达到平衡时体 系能量的变化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出热量:23.15 kJ |
② | 0.9 | 2.7 | 0.2 | 放出热量:Q |
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习物质的组成分类及能量变化练习卷(解析版) 题型:选择题
将18 g铜和铁的混合物投入200 mL稀硝酸中,充分反应后得到标准状况下2.24 L NO,剩余9.6 g金属;继续加入200 mL等浓度的稀硝酸,金属完全溶解,又得到标准状况下2.24 L NO。若向反应后的溶液中加入KSCN溶液,溶液不变红,则下列说法中正确的是( )
A.原混合物中铜和铁各0.15 mol
B.稀硝酸的物质的量浓度为1 mol·L-1
C.第一次剩余9.6 g金属为铜和铁
D.再加入上述200 mL稀硝酸,还会得到标准状况下2.24 L NO
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 离子反应、氧化还原反应练习卷(解析版) 题型:实验题
某小组查文献得知:氧化性I >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2
 S4
S4 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
实验步骤 | 实验过程和现象 | 对应结论 | |
步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 |
_____________ | |
步 骤 2 | 第①份 试液 |
| 碘盐中肯定含 |
第②份 试液 |
|
_____________ | |
第③份 试液 |
| X为 (填化学式) | |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题复习 电解质溶液与电离平衡练习卷(解析版) 题型:选择题
25 ℃时,水的电离达到平衡:H2O H++OH-,下列叙述中正确的是( )
H++OH-,下列叙述中正确的是( )
A.将纯水加热到95 ℃时,KW变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,KW变小
C.向纯水中加入少量固体碳酸钠,c(H+)减小,KW不变,影响水的电离平衡
D.向纯水中加入醋酸钠或盐酸,均可抑制水的电离,KW不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com