
【题目】下表是元素周期表的一部分,回答下列有关问题:
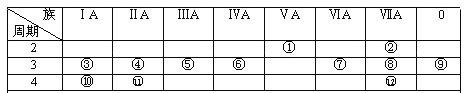
(1)写出下列元素符号:①________,⑥________,⑦________,________。
(2)在这些元素中,最活泼的金属元素是________,最活泼的非金属元素是_______,最不活泼的元素是________。
(3)在这些元素的最高价氧化物对应水化物中,酸性最强的是________,碱性最强的是______,呈两性的氢氧化物是___________,写出三者之间相互反应的化学方程式___。
(4)在这些元素中,原子半径最小的是_________,原子半径最大的是_________。
(5)在③与④中,化学性质较活泼的是________,怎样用化学实验证明?答:________。在⑧与中,化学性质较活泼的是_________,怎样用化学实验证明?答:_________。
【答案】N Si S Ca K F Ar HClO4 KOH Al(OH)3 Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O、KOH+HClO4=KClO4+H2O F K Na 与H2O反应:Na与水剧烈反应,Mg与水不反应 Cl 将Cl2通入到NaBr溶液中,溶液由无色变为橙色,说明Cl的化学性质比Br的活泼
【解析】
(1)根据元素周期表的结构可知:①、⑥、⑦、分别在第二周期VA、第三周期IVA、第三周期VIA和第四周期IIA,则①、⑥、⑦、分别为N、Si、S、Ca;
(2)根据元素周期表性质的递变规律,最活泼的金属应在第IA,最活泼的非金属应在第VIIA,惰性气体最不活泼,则在I A元素Na(③)和K(⑩)中K最活泼;在VII A族元素F(②)、Cl(⑧)和Br()中,F最活泼;最不活泼的是⑨即Ar;
(3)元素的最高价氧化物对应水化物中,酸性最强的必是非金属性增强的,根据同周期、同主族元素非金属性的递变规律可知,元素非金属性最强的是②即F,但F无最高正价;因为我们知道,HClO4已知的最高价含氧酸中酸性最强的,即酸性最强的是HClO4;元素的最高价氧化物对应水化物中,碱性最强的必是非金属性增强的,根据同周期、同主族元素金属性的递变规律可知,元素金属性最强的是⑩即K,则碱性最强的必是KOH;在表中所列元素的最高价氧化物对应水化物中,只有Al(OH)3具有两性;三者之间相互反应的化学方程式分别为Al(OH)3+3HClO4=Al(ClO4)3+3H2O、Al(OH)3+KOH=KAlO2+2H2O、KOH+HClO4=KClO4+H2O;
(4)同周期元素从左至右原子半径依次减小,同主族元素从上而下原子半径依次增大,故在这些元素中,原子半径最小的是F,原子半径最大的是K;
(5)③和④分别是Na和Mg,根据同主族元素金属性的递变规律可知,金属性Na>Mg,根据判断金属性强弱的方法,可依据二者单质分别与水反应的剧烈程度来判断其金属性强弱,即与H2O反应:Na与水剧烈反应,Mg与水不反应;⑧和分别是Cl和Br,根据同主族元素非金属性的递变规律可知,非金属性Cl>Br,根据判断非金属性强弱的方法,可依据二者气态氢化物的稳定性、单质之间的置换反应等来判断其非金属性强弱,即将Cl2通入到NaBr溶液中,溶液由无色变为橙色,说明Cl的化学性质比Br的活泼。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】R、W、X、Y、M是原子序数依次增大的五种主族元素。R最常见同位素的原子核中不含中子。W与X可形成两种稳定的化合物:WX和WX2。工业革命以来,人类使用的化石燃料在燃烧过程中将大量WX2排入大气,在一定程度导致地球表面平均温度升高。Y与X是同一主族的元素,且在元素周期表中与X相邻。
(1)W的原子结构示意图是__________________________。
(2)WX2的电子式是_______________________。
(3)R2X、R2Y中,稳定性较高的是____(填化学式),请从原子结构的角度解释其原因:_____。
(4)Se与Y是同一主族的元素,且在元素周期表中与Y相邻。
①根据元素周期律,下列推断正确的是________(填字母序号)。
a.Se的最高正化合价为+7价
b.H2Se的还原性比H2Y强
c.H2SeO3的酸性比H2YO4强
d.SeO2在一定条件下可与NaOH溶液反应
②室温下向SeO2固体表面吹入NH3,可得到两种单质和H2O,该反应的化学方程式为_____________。
(5)科研人员从矿石中分离出一种氧化物,化学式可表示为M2O3。为确定M元素的种类,进行了一系列实验,结果如下:
①M的相对原子质量介于K和Rb(铷)之间;
②0.01 mol M2O3在碱性溶液中与Zn充分反应可得到M的简单氢化物,反应完全时,被M2O3氧化的Zn为0.06 mol;
综合以上信息推断,M可能位于元素周期表第_________________族。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,体积均为50mL物质的量浓度均为0.10mol/L的HX、HY、HZ三种弱酸,分别用0.10mol/L的NaOH溶液滴定,滴定曲线如图所示。下列有关说法错误的是
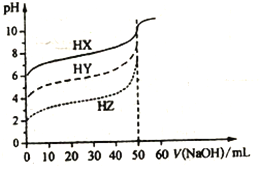
A. 浓度均为0.10mol/L时,酸的电离度:HX<HY<HZ
B. pH均为3.0的三种酸加水稀释至pH均为6.5,加入水的量:HX>HY>HZ
C. 图中当均滴入50mLNaOH溶液时,所得溶液中水的电离程度:HX>HY>HZ
D. 用NaOH溶液中和pH与体积均相等的三种酸时,消耗n(NaOH):HX<HY<HZ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学向SO2和Cl2的混合气体中加入品红溶液,振荡,溶液褪色,将此无色溶液分成三份,依次进行实验,实验操作和实验现象记录如下:
序号 | |||
实验操作 |
|
|
|
实验现象 | 溶液不变红,试纸不变蓝 | 溶液不变红,试纸褪色 | 生成白色沉淀 |
下列实验分析中,不正确的是
A. ①说明Cl2被完全消耗
B. ②中试纸褪色的原因是:SO2 + I2 + 2H2O == H2SO4 + 2HI
C. ③中若将BaCl2溶液换成Ba(NO3)2溶液,也能说明SO2被Cl2氧化为SO42
D. 实验条件下,品红溶液和SO2均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O外,含有CCl4、I2、I- 等)中回收碘,实验过程如下:
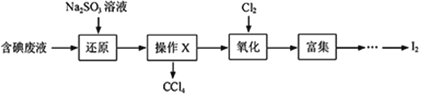
(1)向含碘废液中加入稍过量的Na2SO3溶液,将废液中的I2还原为I-,其离子方程式为___________;该操作将I2还原为I-的目的是________。
(2)操作X的名称为__________。
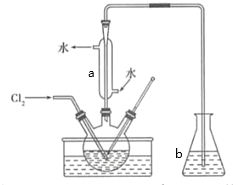
(3)氧化时,在三颈瓶中将含I-的水溶液用盐酸调至pH约为2,缓慢通入Cl2,在40℃左右反应(实验装置如图所示)。实验控制在较低温度下进行的原因是________;仪器a的名称为__________;仪器b中盛放的溶液为________。
(4)已知:![]() ;某含碘废水(pH约为8)中一定存在I2,可能存在I-、
;某含碘废水(pH约为8)中一定存在I2,可能存在I-、![]() 中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
中的一种或两种。请补充完整检验含碘废水中是否含有I-、IO3-的实验方案(实验中可供选择的试剂:稀盐酸、淀粉溶液、FeCl3溶液、Na2SO3溶液)。
①取适量含碘废水用CCl4多次萃取、分液,直到水层用淀粉溶液检验不出有碘单质存在;
②______________________;
③另从水层中取少量溶液,加入1-2mL淀粉溶液,加盐酸酸化后,滴加Na2SO3溶液,若溶液变蓝说明废水中含有IO3-;否则说明废水中不含有IO3-。
(5)二氧化氯(ClO2,黄绿色易溶于水的气体)是高效、低毒的消毒剂和水处理剂。现用氧化酸性含废液回收碘。完成ClO2氧化I-的离子方程式:_____ClO2+ ____I-+_______=_____![]() +_____Cl-+(_________)________。
+_____Cl-+(_________)________。
(6)“碘量法”是一种测定S2-含量的有效方法。立德粉ZnS·BaSO4是一种常用的白色颜料,制备过程中会加入可溶性的BaS,现用“碘量法”来测定立德粉样品中S2-的含量。称取m g样品,置于碘量瓶中,移取25.00mL 0.1000mol/L 的I2-KI溶液于其中,并加入乙酸溶液,密闭,置暗处反应5min,有单质硫析出。以淀粉为指示剂,过量的I2用0.1000mol/L Na2S2O3 滴定,反应式为![]() 。测定消耗Na2S2O3溶液体积V mL。立德粉样品S2-含量为__________(写出表达式)
。测定消耗Na2S2O3溶液体积V mL。立德粉样品S2-含量为__________(写出表达式)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为0.1 mol·L-1、体积均为100 mL的两种一元酸HX、HY的溶液中,分别加入NaOH固体,lg[c(H+)/c(OH-)]随加入NaOH的物质的量的变化如图所示。下列叙述正确的是( )
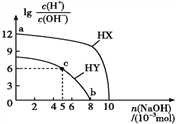
A. HX的酸性弱于HY B. c点溶液中:c(Y-)>c(HY)
C. a点由水电离出的c(H+)=10-12 mol·L-1 D. b点时酸碱恰好完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸甲酯是调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精,用于肥皂、洗涤剂、风味剂和糕点的调味,在医药工业中作为有机合成的中间体.合成肉桂酸甲酯的工业流程如下图所示:
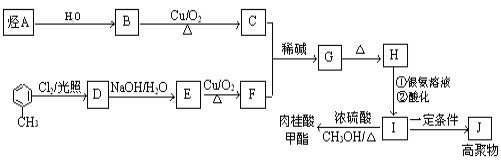
已知:I.醛与醛能发生反应,原理如下:
![]()
Ⅱ.烃A在标准状况下的密度为1.25 g/L.
请回答:
(1)化合物H中的官能团为_____________________________。
(2)肉桂酸甲酯的结构简式为__________________,J的结构简式为________________。
(3)G→H的反应类型为______________________。
(4)写出反应H发生银镜反应的化学方程式_______________,H→I的反应________________(填“能”或“不能”)改用酸性高锰酸钾溶液,简述理由_______________________________________。
(5)符合下列条件的I的同分异构体共有5种。写出另两种同分异构体的结构简式:
A.能发生水解反应
B.与银氨溶液作用出现光亮的银镜
C.能与溴发生加成
 、_____________、_____________。
、_____________、_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E为短周期元素,且原子序数依次增大,质子数之和为39,B、C同周期,A、D同主族,A、C能形成两种液态化合物A2C和A2C2,E元素的周期序数与主族序数相等,元素F与C形成一种具有磁性的物质G。
(1)F元素在周期表中的位置为___;BC2的电子式为___。
(2)由A、B两种元素组成的18电子微粒的分子式为___。
(3)上述元素的气态氢化物中,稳定性最强的是___(填化学式,下同);最高价氧化物对应的水化物是两性化合物的是___,其受热分解后的固态产物可溶于D的最高价氧化物对应的水化物中,其化学方程式为___。
(4)废印刷电路板上含有铜,用A2C2和稀硫酸浸泡废印刷电路板可以溶解铜,写出反应的离子方程式___;写出G与稀硝酸加热反应的离子方程式___。
(5)元素D的单质在一定条件下,能与A单质化合生成一种离子化合物DA,熔点为800℃,若将1molDA和1molE单质混合加入足量的水,充分反应后生成的气体在标准状况下的体积是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.CO2是重要的化工原料,也是应用广泛的化工产品。CO2与过氧化钠或超氧化钾反应可产生氧气。完成下列计算:
(1)CO2通入氨水生成NH4HCO3,NH4HCO3很容易分解。2.00mol NH4HCO3完全分解,分解产物经干燥后的体积为_________L(标准状况)。
(2)某H2中含有2.40 molCO2,该混合气体通入2.00 L NaOH溶液中,CO2被完全吸收。如果NaOH完全反应,该NaOH溶液的浓度为_______。
(3)CO2和KO2有下列反应:
4KO2+2CO2→2K2CO3+3O2 4KO2+4CO2+2H2O→4KHCO3+3O2
若9 mol CO2在密封舱内和KO2反应后生成9 molO2,则反应前密封舱内H2O的量应该是______________。
(4)甲烷和水蒸气反应的产物是合成甲醇的原料:CH4+H2O![]() CO+3H2
CO+3H2
已知:CO+2H2![]() CH3OH CO2+3H2
CH3OH CO2+3H2![]() CH3OH+H2O
CH3OH+H2O
300 mol CH4完全反应后的产物中,加入100 mol CO2后合成甲醇。若获得甲醇350 mol,残留氢气120 mol,计算CO2的转化率_______
Ⅱ.氨碱法制纯碱包括石灰石分解、粗盐水精制、氨盐水碳酸化等基本步骤。完成下列计算:
(5)CaCO3质量分数为0.90的石灰石100 kg完成分解产生CO2_______L(标准状况)。石灰窑中,该石灰石100 kg与焦炭混合焙烧,产生CO2 29120 L(标准状况),如果石灰石中碳酸钙完全分解,且焦炭完全燃烧,不产生CO,则焦炭的物质的量为_______mol。
(6)已知粗盐水含MgCl2 6.80 mol/m3,含CaCl2 3.00mol/m3。向粗盐水中加入Ca(OH)2除镁离子:MgCl2 + Ca(OH)2 → Mg(OH)2↓ + CaCl2然后加入Na2CO3除钙离子。处理上述粗盐水10 m3,至少需要加Na2CO3______g。如果用碳酸化尾气(含NH3体积分数为0.100、CO2体积分数0.040)代替碳酸钠,发生如下反应:Ca2+ + 2NH3 + CO2 + H2O → CaCO3↓ + 2NH4+处理上述10 m3粗盐水至少需要通入_____________L(标准状况)碳酸化尾气。
(7)某氨盐水含氯化钠1521 kg,通入二氧化碳后析出碳酸氢钠晶体,过滤后溶液中含氯化铵1070 kg。
①过滤后溶液中氯化钠的质量______________。
②析出的碳酸氢钠晶体的质量__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com