
| A.②⑤⑧ | B.①④⑥ | C.③④⑦ | D.④⑥⑦ |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.浓硫酸可贮存在铝制容器中 |
| B.浓硫酸使木屑变黑 |
| C.盛浓硫酸的试剂瓶敞口放置在空气中,质量增大 |
| D.盛稀硫酸的试剂瓶敞口放置在空气中,质量减小 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.硫单质与金属铁反应生成FeS,体现了硫单质的氧化性 |
| B.H2S既具有还原性,又具有氧化性 |
| C.SO2能使酸性KMnO4溶液、氯水褪色,说明SO2具有漂白性。 |
| D.SO2在一定条件下可转化为SO3 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
|
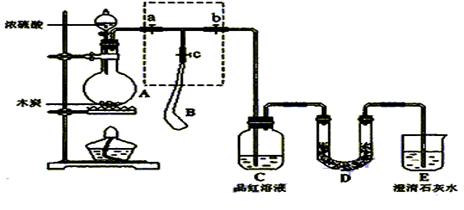 请回答下列问题:
请回答下列问题:  分的装置,则正确的操作
分的装置,则正确的操作 顺序是 (用操作编号填写)
顺序是 (用操作编号填写) 水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氧化剂 | B.还原剂 | C.催化剂 | D.吸附剂 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.氯化钡具有两性 |
| B.SO2有还原性和酸性 |
| C.两支试管内白色沉淀均是亚硫酸钡 |
| D.氯化钡溶液中通入SO2后溶液仍澄清的原因是由于SO2过量,生成了亚硫酸氢钡 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
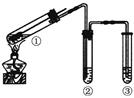
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com