
����Ŀ�����ȸʯ��һ�ֺ�ͭ��ʯ����ͭ��̬Ϊ![]() ��
��![]() ��ͬʱ����
��ͬʱ����![]() ��
��![]() ��
��![]() ��
��![]() �����ʡ�����Ϊԭ����ȡ����ͭ�Ĺ���������ͼ��
�����ʡ�����Ϊԭ����ȡ����ͭ�Ĺ���������ͼ��

��1�������ȸʯ��ĥ�ɷ۵�Ŀ�ģ�__________________���������ϡ������![]() ��Ӧ�Ļ�ѧ����ʽ��__________________��
��Ӧ�Ļ�ѧ����ʽ��__________________��
��2��˫��ˮ��������__________________������![]() ����Ҫ�ɷ�Ϊ__________________��
����Ҫ�ɷ�Ϊ__________________��
��3������ڵ�����Һ![]() ������ѡ�õ��Լ���______��
������ѡ�õ��Լ���______��
A. CuO B. NaOH C.Al2O3 D. Cu(OH)2
��4���й��������↑ʼ��������ȫ������![]() ���±���
���±���
�������� |
|
|
|
|
��ʼ������ | 3.3 | 1.5 | 6.5 | 4.2 |
������ȫ�� | 5.2 | 3.7 | 9.7 | 6.7 |
�����������![]() ����������
����������![]() �ijɷֵĻ�ѧʽΪ____________����Һ
�ijɷֵĻ�ѧʽΪ____________����Һ![]() �г�
�г�![]() �⣬�����еĽ�����������______��
�⣬�����еĽ�����������______��
��5������Һ![]() ͨ��____________�����ɵõ���ˮ����ͭ���塣�ⶨ����ͭ����ᾧˮ�ĺ���ʱ��Ӧ�������______�����ա�����ʧˮ�����ڿ�������ȴ�������ⶨ���______���ƫ�ߡ�����ƫ�͡����䡱����
ͨ��____________�����ɵõ���ˮ����ͭ���塣�ⶨ����ͭ����ᾧˮ�ĺ���ʱ��Ӧ�������______�����ա�����ʧˮ�����ڿ�������ȴ�������ⶨ���______���ƫ�ߡ�����ƫ�͡����䡱����
���𰸡�����Ӵ����������Ӧ���� CuSiO32H2O+H2SO4�TCuSO4+H2SiO3+2H2O ��![]() ������
������![]() SiO2��H2SiO3 AD
SiO2��H2SiO3 AD ![]() ��
��![]()
![]() ����Ũ������ȴ�ᾧ������ ���� ƫ��
����Ũ������ȴ�ᾧ������ ���� ƫ��
��������
�ɻ�ѧ��������ͼ��֪������30%ϡ���ᣬ����ʹ���ȸʯ��CuCO3Cu��OH��2��CuSiO32H2O��FeCO3��Fe2O3��A12O3�ܽ⣬SiO2����Ӧ��CuSiO32H2O�����ᷴӦ��������ͭ�������ˮ���ټ���˫��ˮ�����������£�˫��ˮ��������������Ϊ�����ӣ����ˣ�����A�к��ж���������ᣬ��Һ�к���Cu2+��Fe3+��Al3+����������ͭ��������ͭ������ҺpH��4��������������ȫˮ��ת��Ϊ��������������ȥ�������Ӳ���ת��Ϊ�����������������ˣ�����BΪ��������������������������ҺB�к���ͭ���ӡ������Ӻ������ӣ���ҺBͨ������Ũ������ȴ�ᾧ�����˵�����ͭ���塣
��1�������ȸʯ��ĥ�ɷۿ�������Ӧ��ĽӴ����������Ӧ���ʣ�ʹ��Ӧ���ӳ�֣��������ϡ������CuSiO32H2O��Ӧ��������ͭ�������ˮ����Ӧ�����ӷ���ʽΪ
CuSiO32H2O+H2SO4�TCuSO4+H2SiO3+2H2O���ʴ�Ϊ������Ӵ����������Ӧ���ʣ�CuSiO32H2O+H2SO4�TCuSO4+H2SiO3+2H2O��
��2������˫��ˮ��Ŀ���ǽ��������������������ӣ����ڵ�����ҺpHʱ��������������ת��Ϊ������ȥ�������̿�֪������30%ϡ���ᣬSiO2����Ӧ��CuSiO32H2O�����ᷴӦ��������ͭ�������ˮ��������A�к��ж���������ᣬ�ʴ�Ϊ��Fe2+������ΪFe3+��SiO2��H2SiO3��
��3������ڵ�����ҺpHʱ��������Լ��ܹ��к���Һ�е������ӣ������������µ����ʣ���Ӧ��ѡ��CuO��Cu��OH��2���ʴ�Ϊ��AD��
��4��������������ݿ�֪������ڵ�����ҺpH��4��������������ȫˮ��ת��Ϊ��������������ȥ�������Ӳ���ת��Ϊ��������������������BΪ��������������������������ҺB�к���ͭ���ӡ������Ӻ������ӣ��ʴ�Ϊ��Fe��OH��3��Al��OH��3��Al3+��
��5������ҺB�еõ�����ͭ����IJ���Ϊ����Ũ������ȴ�ᾧ�����ˣ��ⶨ����ͭ�����нᾧˮ�ĺ���ʱ��Ӧ����������������գ������ڿ�����ȴ����������³�����ʣ���������ƫ������ᾧˮ������ƫС�����ƫ�ͣ��ʴ�Ϊ������Ũ������ȴ�ᾧ�����ˣ�������ƫ��


 �¿α�ͬ��ѵ��ϵ�д�
�¿α�ͬ��ѵ��ϵ�д� һ����ʦ����Ӧ����������һ��ȫϵ�д�
һ����ʦ����Ӧ����������һ��ȫϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ľ�ѩ����ͨ���������㣬���д���أ�CH3COOK������ѩЧ����õ���ѩ�������й��ڴ���ص�˵����ȷ���ǣ� ��
A.1 mol CH3COOK������Ϊ98 g/mol
B.CH3COOHĦ����������������Է�������
C.һ��CH3COOH������ԼΪ60/��6.02��1023��g
D.����6.02��1023��̼ԭ�ӵ�CH3COOH�����ʵ�����1 mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����о�������ҩ�������Τ(Remdesivir)��2019������״����(COVID-19)�������������á�FΪҩ��ϳɵ��м��壬��ϳ�·�����£�
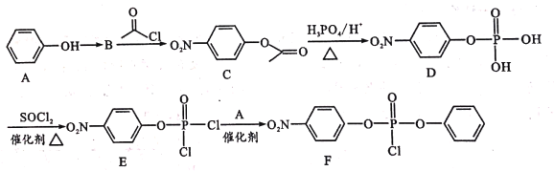
��֪��R-OH![]() R-Cl
R-Cl
(1)A�й�����������________��C�ķ���ʽΪ_____
(2)A��BΪ������Ӧ����B�Ľṹ��ʽΪ___��A��B�ķ�Ӧ������_____��
(3)B��C��D��E�ķ�Ӧ���� ________(������ͬ����������ͬ��)��E��F�Ļ�ѧ����ʽΪ________ ��
(4)H��C��ͬ���칹�壬��������������ͬ���칹����_____�֡�
������ֱ�����ڱ�����
�ں˴Ź����������֮��Ϊ2:2:2:1
����FeCl3��Һ����ɫ
(5)����F�ĺϳ�·��ͼ������� ��SOCl2Ϊԭ���Ʊ�
��SOCl2Ϊԭ���Ʊ� �ĺϳ�·��_______(���Լ���ѡ)��
�ĺϳ�·��_______(���Լ���ѡ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������йص����ӷ�Ӧ����ʽ����ȷ���ǣ� ��
A. ��Mg(HCO3)2��Һ�м��������![]() ��ҺMg2++2HCO3-+4OH-�TMg��OH��2��+2CO32-+2H2O
��ҺMg2++2HCO3-+4OH-�TMg��OH��2��+2CO32-+2H2O
B. FeBr2��Һ��ͨ������ʵ���Cl2��2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-
C. ����������ϡ���ᷴӦ��Fe+4H++NO3-�TFe3++NO��+2H2O
D. ̼��������Һ�м�������ij���ʯ��ˮ��Ca2++2HCO3-+2OH-�TCaCO3��+CO32-+2H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ������������ء�����˵���������
A. PM2.5��ָ����������2.5��m�Ŀ���������������
B. ��ɫ��ѧҪ���Դͷ�����������������Ի�������Ⱦ
C. ȼú�м���CaO���Լ���������γɼ�����������ŷ�
D. ��Ȼ����Һ��ʯ�������ҹ�Ŀǰ�ƹ�ʹ�õ����ȼ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС��Ϊ��ʶ�����仯��������ʡ���ɢϵ��������������һ���ۺ�ʵ�飬����ʵ�����̻ش�������⣺

(1)��д��Fe2O3��ٷ�Ӧ�����ӷ���ʽ______________________________��
(2)���ʢ�Ϊ_______________��
(3)��д��FeCl3�����۷�Ӧ�Ļ�ѧ����ʽ________________________��
(4)��FeCl2��Һ�еμ�NaOH��Һ��������Fe(OH)3��Һ���ù��̵�����Ϊ____________ ���˹����з�����������ԭ��ӦΪ(�û�ѧ����ʽ����)_________________________��
(5)��FeCl3������Һ�����ˮ�У���������������ɫ���Ƶ÷�ɢϵ��Ϊ__________________������FeCl3��Һ��Fe(OH)3��Һ�ı���������_________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�ǹ�ҵ��ⱥ��ʳ��ˮ��װ��ʾ��ͼ������˵���в���ȷ����
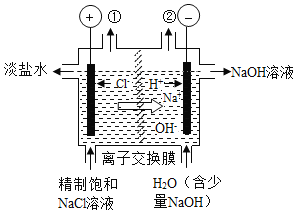
A. װ�ó��ڢٴ�������������
B. ���ڢڴ��������������������ӽ���Ĥֻ����������ͨ��
C. װ���з����ķ�Ӧ�����ӷ���ʽ2Cl��+2H+![]() Cl2��+H2��
Cl2��+H2��
D. ��װ���ǽ�����ת��Ϊ��ѧ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ҹ���CO2������շ���ȡ��ͻ���Խ�չ��CO2ת������ʾ��ͼ��ͼ������˵������ȷ���ǣ�������
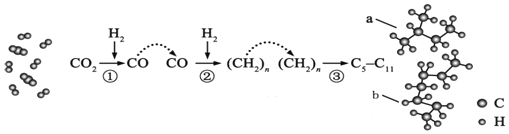
A. ����![]() �еIJ����к���
�еIJ����к���![]()
B. �ù�����һ���̶����ܹ��ؿ���ȡ���͵�;��
C. ������a��b��Ϊͬϵ��
D. ͼ��a�ı���ģ��������![]() ������
������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ͨ�����и�Ũ��SO2���������P�۳��������к����ʣ����ŷ�ǰ���������������������
(1) ���ü���ɽ��������ﻹԭΪ������ȥ����֪��
2NO(g)��O2(g)=2NO2(g)����H��a kJ��mol��1
CH4(g)��2O2(g)=CO2(g)��2H2O(g)����H��b kJ��mol��1
CH4(g)��2NO2(g)=N2(g)��CO2(g)��2H2O(g)����H��c kJ��mol��1
��ӦCH4(g)��4NO(g)=2N2(g)��CO2(g)��2H2O(g)����H��________ kJ��mol��1��
(2) H2O2�ڴ�����FeOOH�ı����ϣ��ֽ������OH����OH��H2O2��O2�����������е�NO��SO2������Ӧ����Ӧ�����ò��������ɫ����ͼ1��ʾ��
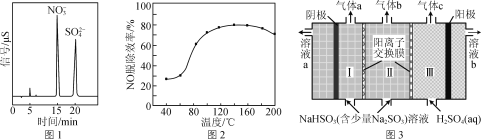
��д����OH����NO�Ļ�ѧ��Ӧ����ʽ��________��
�ڵ�H2O2Ũ��һ��ʱ��NO���ѳ�Ч�����¶ȵĹ�ϵ��ͼ2��ʾ��������80 �����ϣ�����������H2O2��ʹNO���ѳ�Ч��������ߵ�ԭ����______________________________���¶ȸ���180 ����NO���ѳ�Ч�ʽ��͵�ԭ����________��
(3) ��ҵ�ɲ�����������������Һ�ѳ������еĶ�������Ӧ��˫�����ӽ���Ĥ��⼼����ʹ������Һ������ͬʱ�õ���Ũ��SO2���乤��ԭ����ͼ3��ʾ��
�� SO2������________(��������������)�����ɡ�
�������ӷ���ʽ��ʾ����Һ������ԭ����________��
(4) �������ײ�����ȱλ������(ZnFe2Ox)�ܽ�������SO2�ֽ��ȥ����1 mol ZnFe2Ox������SO2����1 mol ZnFe2O4��0.5 mol S����x��________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com