
【题目】化学上常用下图表示基本反应类型与氧化还原反应关系,其中阴影部分可以表示 ( )

A. 置换反应 B. 复分解反应 C. 所有的分解反应 D. 有电子转移的化合反应
【答案】D
【解析】
化学反应的四种基本类型:化合反应、分解反应、置换反应、复分解反应;根据四大基本反应类型和氧化还原反应之间的关系来回答;部分化合反应属于氧化还原反应,部分分解反应属于氧化还原反应
根据化合价是否发生变化,可以将化学反应分为氧化还原反应和非氧化还原反应;根据反应物、生成物的种类及其变化,可以将化学反应分为:化合反应、分解反应、置换反应、复分解反应。部分化合反应属于氧化还原反应,部分分解反应属于氧化还原反应,所有的置换反应均是氧化还原反应,所有的复分解反应均不是氧化还原反应,
A、所有的置换反应均是氧化还原反应,故A不选;
B、所有的复分解反应均不是氧化还原反应,故B不选;
C、所有的分解反应,只有部分分解反应属于氧化还原反应,故C不选;
D、有电子转移的化合反应,这部分化合反应属于氧化还原反应,故D符合;
故选D。


 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案科目:高中化学 来源: 题型:
【题目】碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题:
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:![]()
副反应:![]()
①工业上往往采用物料比![]() 在1.7—2.0之间,主要目的是____________。
在1.7—2.0之间,主要目的是____________。
②下表所示是部分化学键的键能参数:
化学键 | N-N | O=O |
键能/kJ· mol-1 | 946 | 497.3 |
则拆开1mol NO中的化学键需要吸收的能量是__________kJ。
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g)![]() 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
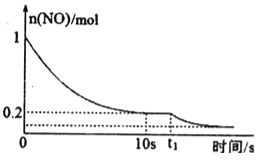
①前10 s内N2的平均生成速率为____。
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是____。(填写一种)
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
①CO2 的平衡转化率等于______,反应平衡常数K等于______(保留两位有效数字)。
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g)![]() Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g)![]() Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 0.05 mol液态KHSO4中含有0.1NA个阳离子
B. 1 L 0.1 mol·L-1的氨水中有0.1NA个NH![]()
C. 标准状况下,22.4 L盐酸含有NA个HCl分子
D. 23gNa与O2在一定条件下反应生成Na2O和Na2O2的混合物,共转移NA个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组电极均用导线相连,分别插入对应溶质的溶液中,其中不能组成原电池的是
A | B | C | D | |
电极与溶液 | Zn、石墨、硫酸 | Cu、Ag、硝酸银 | Mg、Al、氢氧化钠 | Zn、Cu、蔗糖 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由两种元素组成的化合物M,是某种具有优异磁学性质的新型电子材料的主要成分。其制备流程如下:
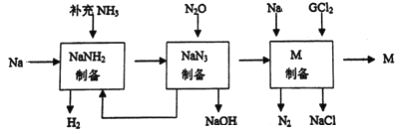
取2.38g 的M 用足量稀硫酸溶解,在所得反应液中加入足量的NaOH溶液,发现有刺激性气味且能使湿润红色石蕊试纸变蓝的气体产生,同时溶液中产生白色沉淀,迅速变成灰绿色,最终变为红褐色,沉淀灼烧后质量为3.20g。请回答:
(1)写出NaNH2的电子式________, M的化学式________________;
(2)根据图示信息,用一个化学方程式表示NaN3制备方法_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知As2O3与Zn可以发生如下反应:As2O3+6Zn+6H2SO4![]() 2AsH3↑+6ZnSO4+3H2O。
2AsH3↑+6ZnSO4+3H2O。
(1)请用双线桥法标出电子转移的方向和数目____________________________________。
(2)As2O3在上述反应中显示出来的性质是____________(填序号)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是__________,还原产物是________。
(4)若生成0.2 mol AsH3,则转移的电子数为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种短周期元素的有关数据如下表,下列叙述正确的是
元素代号 | X | Y | Z | W |
原子半径/pm | 66 | 70 | 143 | 160 |
主要化合价 | -2 | +5、+3、-3 | +3 | +2 |
A. X、Y、Z、W的离子半径由大到小的顺序为X>Y>W>Z
B. Y的最高价氧化物对应的水化物为强酸
C. Y的气态氢化物的稳定性高于X
D. 工业上采用电解熔融状态的Z的氯化物制备Z单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将0.1molCH3COONa和0.05molHCl溶于水配成1L溶液(pH<7).
(1)用离子方程式表示该溶液中存在的三个平衡体系______________、_______________、___________________
(2)溶液中各离子的物质的量浓度由大到小顺序为_____________________________________________________
(3)溶液中粒子中浓度为0.1mol/L的是________________,浓度为0.05mol/L的是____________________
(4)物质的量之和为0.lmol的两种粒子是______________与__________
(5)CH3COO-和OH-的物质的量之和比H+多________mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com