
【题目】碳、氮等元素及其化合物和人类生产、生活密切相关,请回答下列问题:
(1)氨催化氧化是硝酸工业的基础,生产过程中会发生以下反应:
主反应:![]()
副反应:![]()
①工业上往往采用物料比![]() 在1.7—2.0之间,主要目的是____________。
在1.7—2.0之间,主要目的是____________。
②下表所示是部分化学键的键能参数:
化学键 | N-N | O=O |
键能/kJ· mol-1 | 946 | 497.3 |
则拆开1mol NO中的化学键需要吸收的能量是__________kJ。
(2)在一定温度下,向1L密闭恒容容器中充入l mol NO和一定物质的量的CO,在催化剂作用下发生反应:2NO (g)+2CO (g)![]() 2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
2CO2(g)+N2(g) ΔH>0,NO的物质10 s随反应时间t的变化曲线如图:
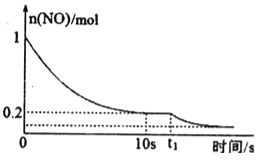
①前10 s内N2的平均生成速率为____。
②已知在t1时刻反应速率加快,则在t1时刻改变的条件可能是____。(填写一种)
(3)在723K时,将0.1mol H2和0.2mol CO2通入抽空的上述密闭容器中,发生如下反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
CO(g)+H2O(g),反应平衡后,水的物质的量分数为0.10。
①CO2 的平衡转化率等于______,反应平衡常数K等于______(保留两位有效数字)。
②再向容器中加入过量的CoO (s)和Co (s),则容器中又会增加如下平衡:CoO (s) +H2 (g)![]() Co (s) +H2O(l)K1;CoO (s) +CO (g)
Co (s) +H2O(l)K1;CoO (s) +CO (g)![]() Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
Co (s) +CO2(g) K2。最后反应平衡时,容器中水的物质的量分数为0. 30,则K1等于____。
【答案】 促进主反应发生,提高NH3的转化率 630.9 0.04 mol·L-1·s-1 升高温度或者增加了CO的浓度 15% 0.076 9
【解析】(1)①主要反应方程式中![]() =1.25,副反应中
=1.25,副反应中![]() =0.75,采用物料比
=0.75,采用物料比![]() 在1.7~2.0之间,增加O2的量,有利于反应按主反应进行,且使主反应的平衡向正反应方向移动,提高NH3的转化率。②(主反应-副反应)÷2得:N2(g)+O2(g)
在1.7~2.0之间,增加O2的量,有利于反应按主反应进行,且使主反应的平衡向正反应方向移动,提高NH3的转化率。②(主反应-副反应)÷2得:N2(g)+O2(g)![]() 2NO(g) ΔH=(-905 kJ·mol-1+1268 kJ·mol-1)÷2=+181.5 kJ·mol-1。设拆开1molNO中的化学键需要消耗xkJ的能量,则:946+497.3-2x=181.5,解得x=630.9。(2)①前10 s内N2的平均生成速率,v(N2)=
2NO(g) ΔH=(-905 kJ·mol-1+1268 kJ·mol-1)÷2=+181.5 kJ·mol-1。设拆开1molNO中的化学键需要消耗xkJ的能量,则:946+497.3-2x=181.5,解得x=630.9。(2)①前10 s内N2的平均生成速率,v(N2)= 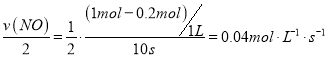 。②由图知,在t1时刻,NO的物质的量逐渐减少,说明平衡向正反应方向移动,而反应速率加快,说明改变的条件可能是升高温度或者增加了CO的浓度。(3)①根据反应方程式,设反应到达平衡后,CO2转化了amol,则:
。②由图知,在t1时刻,NO的物质的量逐渐减少,说明平衡向正反应方向移动,而反应速率加快,说明改变的条件可能是升高温度或者增加了CO的浓度。(3)①根据反应方程式,设反应到达平衡后,CO2转化了amol,则:
CO2(g) + H2(g) ![]() CO(g) + H2O(g)
CO(g) + H2O(g)
起始物质的量 0.2mol 0.1mol 0 0
转化的物质的量 amol amol amol amol
平衡时物质的量 (0.2-a)mol (0.1-a)mol amol amol
![]() ,解得a=0.03
,解得a=0.03
CO2的平衡转化率: ![]()
反应平衡常数![]()
②容器中各个反应前后气体的物质的量不变,所以在加入过量的CoO(s)和Co(s)并达到新的平衡后,所有气体的总物质的量仍然为:0.2mol+0.1mol=0.3mol。此时H2O的物质的量为:0.3mol×0.30=0.09mol。根据质量守恒,此时H2的物质的量为:0.1mol-0.09 mol =0.01mol。![]()


科目:高中化学 来源: 题型:
【题目】已知:乙二酸俗称草酸(结构简式为HOOC-COOH,可简写为H2C2O4)。25℃时,草酸的电离平衡常数为K1=5.0×10-2,K2=5.4×10-5;碳酸(H2CO3)的电离平衡常数为K1=4.5×10-7,K2=4.7×10-11。草酸钙的Ksp=4.0×10-8,碳酸钙的Ksp=2.5×10-9。回答下列问题:
(1)写出水溶液中草酸的电离方程式_____________________________________ 。
(2)相同条件下物质的量浓度都为0.1mol/L的Na2C2O4溶液的pH比Na2CO3溶液的pH______________ (填“大”、“小”或“相等”) 。
(3)常温下将0.4mol/L的KOH溶液20mL与0.2mol/L的草酸溶液20mL混合,则混合后溶液中阴离子浓度的大小顺序为_____________________________________ 。
(4)往Na2CO3溶液中加入少量草酸溶液,发生反应的离子方程式为________________。
(5)25℃时,向20mL碳酸钙的饱和溶液中逐滴加入c mol/L的草酸钾溶液20mL后,有草酸钙沉淀生成,则c的最小值为__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 0.1 mol·L-1氨水中,c(OH-)=c(NH4+)
B. 10 mL 0.02 mol·L-1 HCl溶液与10 mL 0.02 mol·L-1 Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
C. 在0.1 mol·L-1的(NH4)2SO4溶液中,c(SO42-)>c(NH4+)>c(H+)>c(OH-)
D. 0.1 mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)=2c(A2-)+c(HA-)+c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,可充电的钠——二氧化碳电池是当今新能源领域的热点,具有优异的性能。下列说法正确的是( )
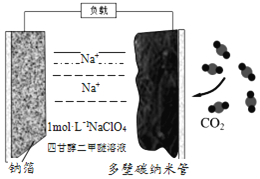
A. 钠金属片为正极
B. 该电池中的电解质为NaClO4,工作时ClO4-向碳纳米管电极移动
C. 总反应为:![]()
D. 放电时,每消耗3molCO2,转移12mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】燃料电池能有效提高能源利用率,具有广泛的应用前景.下列物质均可用作燃料电池的燃料,其中最环保的是( )
A.一氧化碳
B.天然气
C.乙醇
D.氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)H2O的摩尔质量为:_________ , 36 g 水的物质的量为:_____________如果将这36 水完全电解生成H2和 O2,则所得H2在标况下的体积约为:_________________
(2)1 mol Na2O2中所含阴离子数的个数约为:_________(用NA表示)
(3)将0.5 mol Na2CO3固体加水溶解配成250 mL溶液, c(Na+)=____ mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.正丁烷和异丁烷属于同系物
B.乙烯和苯都能与 H2 发生加成反应,说明二者的分子中均含碳碳双键
C.乙醇与金属钠能反应,且在相同条件下比水与金属钠的反应要缓慢
D.乙醛能被还原成乙醇,但不能被氧化成乙酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学上常用下图表示基本反应类型与氧化还原反应关系,其中阴影部分可以表示 ( )

A. 置换反应 B. 复分解反应 C. 所有的分解反应 D. 有电子转移的化合反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com