
黄铜矿主要成分是二硫化亚铁铜(CuFeS2)。黄铜矿经熔炼、煅烧后得到粗铜和炉渣,冶炼过程的主要反应有: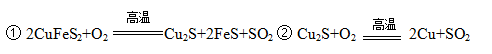
(1)二硫化亚铁铜也可以表示为CuS·FeS,其中硫元素的化合价是 。
(2)反应②中还原剂是 。
(3)某校学习小组用炼铜产生的炉渣(含Fe2O3、FeO、SiO2、Al2O3等)制备铁红,进行如下实验。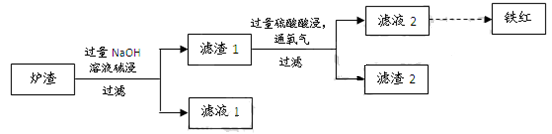
① 炉渣碱浸时反应的离子方程式是 、 。
② 滤渣1中加入硫酸并通入氧气可使FeO转化为Fe3+,该反应的离子方程式是 ;为检验铁元素是否被氧化完全,应进行的实验是:取少量滤液2于试管中 。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:单选题
钠与水反应的离子方程式正确的是( )
| A.2Na+3H+=2Na++H2↑ |
| B.Na+H2O=Na++OH-+H2↑ |
| C.2Na+2H2O=2Na++2OH-+H2↑ |
| D.2Na+2H2O=2Na++O2↑+2H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(6分)完成下列反应的离子方程式:
(1)向NaHSO4溶液中逐滴加入Ba(OH)2溶液,使原溶液中的SO42—恰好完全沉淀:
(2)向明矾溶液中逐滴加入Ba(OH)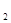 溶液,当Al3+恰好全部沉淀时:
溶液,当Al3+恰好全部沉淀时:
(3)向Ca(HCO3) 2溶液中加入过量的NaOH溶液:
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某无色溶液X,由Na+、Ag+、Ba2+、Al3+、[Al(OH)4]--、 MnO4—、CO32-- 、SO42—中的若干种离子组合,取溶液进行如下连续试验:(填化学用语)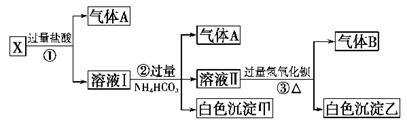
(1)气体A的成分是:_________________,气体B的成分是_____________
(2)X溶液中一定存在的离子是:____________________________
(3)写出步骤①发生反应的所有离子反应方程式:_________________________
(4)写出步骤②形成白色沉淀甲的离子方程式:______________________
(5)写出白色沉淀乙的可能组成:____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(16分)卤块的主要成分是MgCl2,此外还含Fe2+、Fe3+和Mn2+等杂质离子。以卤块为原料按下图所示流程进行生产,可制得轻质氧化镁。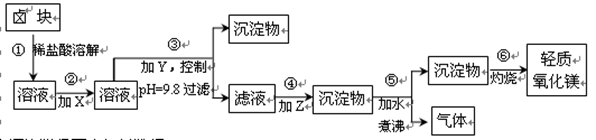
查阅资料得下表相关数据:
| 表1: 生成氢氧化物沉淀的pH | 表2: 原料价格表 | |||
| 物质 | 开始沉淀 | 沉淀完全 | 物质 | 价格(元/吨) |
| Fe(OH)3 | 2.7 | 3.7 | a.漂液(含25.2%NaClO) | 450 |
| Fe(OH)2 | 7.6 | 9.6﹡ | b.双氧水(含30%H2O2) | 2400 |
| Mn(OH)2 | 8.3 | 9.8 | c.烧碱(含98%NaOH) | 2100 |
| Mg(OH)2 | 9.6 | 11.1 | d.纯碱(含99.5%Na2CO3) | 600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
【化学——选修2:化学与技术】(15分)
电镀厂镀铜废水中含有CN-和Cr2O72-离子,需要处理达标后才能排放。该厂拟定下列流程进行废水处理,回答下列问题: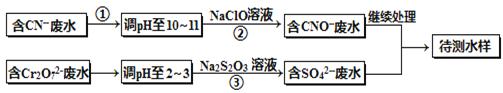
(1)上述处理废水流程中主要使用的方法是_________________;
(2)②中反应后无气体放出,该反应的离子方程式为______________;
(3)步骤③中,每处理0.4mol Cr2O72-时转移电子2.4mol,该反应的离子方程式为 ;
(4)取少量待测水样于试管中,加入NaOH溶液,观察到有蓝色沉淀生成,再加Na2S溶液,蓝色沉淀转化成黑色沉淀,请使用化学用语和文字解释产生该现象的原因 ;
(5)目前处理酸性Cr2O72-废水多采用铁氧磁体法。该法是向废水中加入FeSO4 ·7H2O将Cr2O72-还原成Cr3+,调节pH,Fe、Cr转化成相当于: (铁氧磁体,罗马数字表示元素价态)的沉淀。
(铁氧磁体,罗马数字表示元素价态)的沉淀。
处理1mol Cr2O72-,需加入a mol FeSO4 ? 7H2O,下列结论正确的是_______。
| A.x ="0.5" ,a ="8" | B.x ="0.5" ,a =" 10" | C.x =" 1.5" ,a =8 | D.x =" 1.5" ,a = 10 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
以黄铁矿(FeS2)、氯酸钠和硫酸溶液混合反应制备二氧化氯气体,再用水吸收获得二氧化氯溶液。在此过程中需要控制适宜的温度, 若温度不当,副反应增加,影响生成ClO2气体的纯度,且会影响ClO2气体的吸收率。具体情况如图所示。请回答下列问题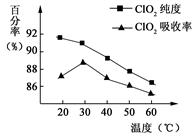
(1)据图可知,反应时需要控制的适宜温度是 ℃,达到此要求采取的适宜措施是 。
(2)已知:黄铁矿中的硫元素在酸性条件下被ClO3-氧化成SO42-,写出制备二氧化氯的离子方程式: 。
(3)某校化学学习小组拟以“m(ClO2)/m(NaClO3)”作为衡量ClO2产率的指标。若取NaClO3样品质量6.0g,通过反应和吸收可得400 mL ClO2溶液,取出20 mL,加入37.00 mL 0.500mol·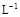 (NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·
(NH4)2Fe(SO4)2 溶液充分反应,过量Fe2+再用0.0500 mol·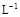 K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
K2Cr2O7标准溶液滴定至终点,消耗20.00 mL。反应原理如下:
4H++ClO2+5Fe2+=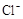 +5Fe3+ +2H2O 14H+ +
+5Fe3+ +2H2O 14H+ +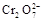 +6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
+6 Fe2+ =2Cr3+ + 6 Fe3+ +7H2O
试计算ClO2的“产率”。(写出计算过程)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为____________________;
(2)实验③中的现象为_____________________________________________________;
(3)实验①、②中反应的离子方程式分别是__________、________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
有一瓶无色澄清的溶液,其中可能含Na+、Mg2+、H+、Fe3+、CO32-、Cl-、Br-中的一种或几种,取该溶液进行如下实验:
①用PH试纸检验,表明溶液呈强酸性
②取部分溶液,加入少量的CCl4及数滴新制的氯水,振荡后CCl4层显橙红色
③将②得到的溶液滴加硝酸银溶液,有白色沉淀生成,滴加稀硝酸沉淀不溶解。
④另取部分溶液,逐滴加入稀NaOH溶液,使溶液从酸性逐渐转变为碱性,在滴加过程中及滴加完毕后,溶液中均无沉淀生成
根据上述实验事实确定并回答:
(1)在溶液中,肯定存在的离子有 。
(2)肯定不存在的离子有 。
(3)可能存在的离子有 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com