
【题目】下列各组离子在常温下一定能大量共存的是( )
A.在0.1 mol·L-1FeCl3溶液中:K+、Na+、I-、SCN-
B.在![]() =1012的溶液中:Al3+、NO3-、K+、Cl-
=1012的溶液中:Al3+、NO3-、K+、Cl-
C.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
科目:高中化学 来源: 题型:
【题目】将炼钛厂、氯碱厂和甲醇厂组成产业链如下,可得到烧碱、甲醇、钛以及其他一些有用的副产品。
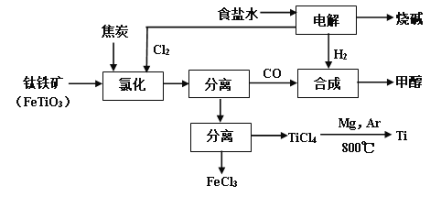
已知:合成甲醇的主反应为:CO+2H2![]() CH3OH+Q(Q>0,下同);
CH3OH+Q(Q>0,下同);
同时有副反应如:8CO+17H2![]() C8H18+8H2O+Q;4CO+8H2
C8H18+8H2O+Q;4CO+8H2![]() C4H9OH+3H2O+Q。
C4H9OH+3H2O+Q。
请完成下列填空:
(1)在实验室电解饱和食盐水时,因工业食盐中含有少量氯化钙、硫酸镁等杂质,除杂时先加入沉淀剂,然后过滤,滤渣的成分是__________(填写化学式)。
(2)写出钛铁矿经氯化法得到四氯化钛的化学方程式_________。
(3)诸如上述联合生产,其优点有_______。生产中除了获得上述目标产品外,还能得到副产品________(填写化学式)。
(4)在上述产业链中,合成192吨甲醇理论上需额外补充H2 _____吨(不考虑生产过程中物质的损失及副反应)。
(5)上述产业链中“氯化”在6000C以上的反应器内进行。已知:
物质 | 沸点(0C) |
TiCl4 | 136 |
FeCl3 | 315 |
为了将TiCl4从“氯化”后的混合物中分离出来,请设计合理的方案:_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与硫同族的元素Te,最高价氧化物的水化物碲酸(H6TeO6)的酸性比H2SO4____(选填“强”或“弱”),其氧化性比硫酸强。向碲酸中通入SO2气体,若反应中生成的TeO2与Te的物质的量之比为2:1,写出该反应的化学方程式______________。当6mol碲酸与一定量SO2恰好完全反应,所得溶液体积为20L,则所得溶液的pH为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组采用电渗析法从含NH4H2PO4 和(NH4)2HPO4的废水中回收NH3·H2O和 H3PO4,装置如图所示。下列说法错误的是( )
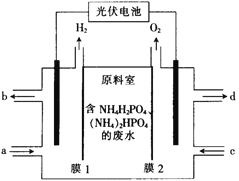
A.膜1为阳离子交换膜,膜2为阴离子交换膜
B.a处进入稀氨水,d处流出浓H3PO4溶液
C.阴极区总反应式为2H2O+2NH4++2e-=2NH3·H2O+H2↑
D.每放出11.2L(标准状况)H2时,能回收98gH3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是
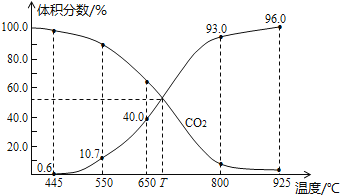
A.550℃时,若充入惰性气体,v正,v逆均减小
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,有如下实验现象:开始时插在小试管中的导管内的液面下降,一段时间后导管内的液面回升,略高于U型管中的液面。以下有关解释不合理的是

A. 生铁片中所含的碳能增强铁的抗腐蚀性
B. 雨水酸性较强,生铁片开始发生析氢腐蚀
C. 导管内墨水液面回升时,正极反应式:O2+2H2O+4e—==4OH-
D. 随着反应的进行,U型管中雨水的酸性逐渐减弱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl22H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是__ (填字母编号)
a CuO b NaOH c Cu2(OH)2CO3 d Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl22H2O.
①蒸发过程中,加入盐酸的目的是____.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是:![]()

上述反应的化学平衡常数表达式是______.欲使溶液由绿色变成蓝色的措施是:a______;b______.
(4)由CuSO4溶液蒸发结晶得到CuSO45H2O的过程中不用加入硫酸,其原因是______(用勒夏特列原理解释).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海带中提取碘的一种工业生产过程如下:

下列说法中错误的是
A.步骤(1)需要过滤装置
B.步骤(2)需要用到分液漏斗
C.“碱化”目的是让可溶性有机质形成沉淀
D.“氧化”是让I-转化为I2,可以用适量氯气作氧化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com