
【题目】氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl22H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是__ (填字母编号)
a CuO b NaOH c Cu2(OH)2CO3 d Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl22H2O.
①蒸发过程中,加入盐酸的目的是____.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是:![]()

上述反应的化学平衡常数表达式是______.欲使溶液由绿色变成蓝色的措施是:a______;b______.
(4)由CuSO4溶液蒸发结晶得到CuSO45H2O的过程中不用加入硫酸,其原因是______(用勒夏特列原理解释).
【答案】MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O ac 抑制铜离子的水解,提高产品的产率
Mn2++Cl2↑+2H2O ac 抑制铜离子的水解,提高产品的产率 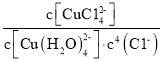 加水稀释 AgNO3溶液 Cu2+易发生水解,加热促进水解;但硫酸不挥发,且浓度越来越大,从而抑制水解;水不断蒸发,最终得到晶体
加水稀释 AgNO3溶液 Cu2+易发生水解,加热促进水解;但硫酸不挥发,且浓度越来越大,从而抑制水解;水不断蒸发,最终得到晶体
【解析】
(1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质;
(3)①铜离子水解显酸性,加酸抑制水解;
②根据反应方程式书写,水不能写入平衡常数表达式;溶液由绿色变成蓝色,则平衡逆向移动,根据影响化学平衡移动的因素分析;
(4)CuSO4在溶液中水解生成难挥发性酸,水解不能完全进行。
(1)在加热条件下浓盐酸与二氧化锰反应生成氯气、氯化锰和水,其反应的离子方程式为:MnO2+4H++2Cl﹣![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)调节pH时不能消耗铜离子,也不能引入新的杂质,加NaOH会引入钠离子,Cu与氢离子不反应,所以可以选用CuO和Cu2(OH)2CO3,故答案为:ac;
(3)①铜离子水解显酸性,加酸抑制水解,所以蒸发过程中,要加入盐酸来抑制氯化铜的水解,从而提高产率;
②蒸发过程中,观察到溶液颜色由蓝色变为绿色,其原理是:![]() ,则反应的平衡常数为K=
,则反应的平衡常数为K=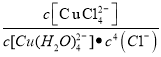 ;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
;溶液由绿色变成蓝色,则平衡逆向移动,加水稀释,平衡逆向移动,加AgNO3溶液会消耗氯离子,反应物的浓度减小,平衡逆向移动;
(4)CuSO4在溶液中水解生成难挥发性酸硫酸,加热促进水解,但水解生成的硫酸不挥发,随着水的减少,硫酸的浓度越来越大,从而抑制了硫酸铜的水解,最终得到晶体。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】工业上将Cl2通入KOH热溶液中制取KClO3(混有KClO)。实验室模拟上述制备:向含18mol KOH的溶液中通入Cl2,充分反应后测得溶液中n(Cl-)=12mol,将此溶液低温蒸干,所得到固体中KClO3的物质的量可能为
A.1.5molB.2.1molC.2.4 molD.3.0 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在常温下一定能大量共存的是( )
A.在0.1 mol·L-1FeCl3溶液中:K+、Na+、I-、SCN-
B.在![]() =1012的溶液中:Al3+、NO3-、K+、Cl-
=1012的溶液中:Al3+、NO3-、K+、Cl-
C.1.0 mol·L-1的KNO3溶液中:H+、Fe2+、Cl-、SO42-
D.通入大量CO2的溶液中:Na+、ClO-、CH3COO-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在相同温度下,0.01 mol/L的NaOH溶液和0.01 mol/L的盐酸相比较,下列说法正确的是( )
A.由水电离出的c(OH-)相等
B.由水电离出的c(H+)都是1.0×10-12 mol/L
C.两溶液的pH之和等于14
D.若将0.01 mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙炔(C2H2)和丙烯腈(![]() )是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
)是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
(1) Cu+的基态核外电子排布式为________。Cu元素在周期表中位置____________。无水CuSO4晶体是白色晶体,溶于水得蓝色溶液,显蓝色的离子的化学式为___________;向蓝色的硫酸铜溶液中滴加氨水直至过量,再加入无水乙醇,最终现象是___________。
(2)![]() 的电子式为________。
的电子式为________。
(3) 与CN-互为等电子体的分子是________(填常见、稳定物质的化学式)。
(4) 丙烯腈分子中碳原子轨道的杂化类型是________。
(5) 1 mol丙烯腈分子中含π键的数目为________mol。
(6)丙烯腈(![]() )分子中共面的原子数目最多为________。
)分子中共面的原子数目最多为________。
(7)H2O分子的VSEPR模型是________,分子的立方体构型是____________。水凝结成冰,冰中水分子的配位数是__________冰的密度比水小,原因是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】稀氨水中存在如下平衡:NH3+H2O ![]() NH3·H2O
NH3·H2O![]() NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
A.加入氯化铵固体,平衡逆向移动,溶液pH降低
B.通入更多氨气,平衡正向移动,溶液碱性增强
C.加入氢氧化钠固体,平衡逆向移动,溶液导电性增强
D.加入适量 NaCl溶液,平衡不移动,溶液pH不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇是肿瘤的化学预防剂,也是对降低血小板聚集,预防和治疗动脉粥样硬化、心脑血管疾病的化学预防剂。花生、葡萄(红葡萄酒)、虎杖、桑椹等植物含有相当多的白蓼芦醇,白藜芦醇是“100种最热门有效抗衰老物质”之一。其结构简式如图,下列有关说法正确的是( )
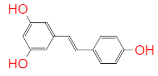
A.白藜芦醇属于酚类物质,是一种天然的抗氧化剂
B.白藜芦醇极易溶于水,遇Fe3+能发生显色反应,还能被高锰酸钾氧化
C.1 mol 白藜芦醇最多能与 NaOH或H2反应的物质的量为3 mol、6 mol
D.白藜芦醇的所有原子一定不在同一平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解得到的乙烯和1,3-丁二烯为原料,经过下列反应合成高分子化合物H,该物质可用于制造以玻璃纤维为填料的增强塑料(俗称玻璃钢)。
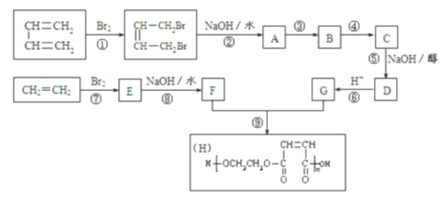
请按要求填空:
(1)写出上述指定反应的化学反应类型:
反应①____________,反应⑤______________,反应⑧________________。
(2)反应②的化学方程式是___________________________________________。
(3)反应③、④中有一反应是与HCl加成,该反应是__________(填反应编号),设计这一步反应的目的是___________________,物质C的结构简式是____________________。
(4)写出A的同分异构体(要求不含甲基并能发生银镜反应)__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示的方案可以降低铁闸门的腐蚀速率。下列判断正确的是( )
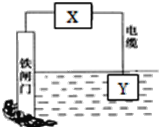
A.若X为导线,Y可以是锌
B.若X为导线,铁闸门上的电极反应式为Fe-2e-=Fe2+
C.若X为直流电源,铁闸门做负极
D.若X为直流电源,Y极上发生还原反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com