
【题目】乙炔(C2H2)和丙烯腈(![]() )是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
)是有机合成工业的重要原料。工业上曾用CaC2和H2O反应制取乙炔,用乙炔和氢氰酸(HCN)在氯化亚铜等催化作用下生产丙烯腈。
(1) Cu+的基态核外电子排布式为________。Cu元素在周期表中位置____________。无水CuSO4晶体是白色晶体,溶于水得蓝色溶液,显蓝色的离子的化学式为___________;向蓝色的硫酸铜溶液中滴加氨水直至过量,再加入无水乙醇,最终现象是___________。
(2)![]() 的电子式为________。
的电子式为________。
(3) 与CN-互为等电子体的分子是________(填常见、稳定物质的化学式)。
(4) 丙烯腈分子中碳原子轨道的杂化类型是________。
(5) 1 mol丙烯腈分子中含π键的数目为________mol。
(6)丙烯腈(![]() )分子中共面的原子数目最多为________。
)分子中共面的原子数目最多为________。
(7)H2O分子的VSEPR模型是________,分子的立方体构型是____________。水凝结成冰,冰中水分子的配位数是__________冰的密度比水小,原因是_________。
【答案】1s22s22p63s23p63d10 第四周期ⅠB 族 [Cu(H2O)4]2+ 析出深蓝色晶体 ![]() N2或CO sp和sp2 3 7 四面体 V字形 4 氢键的方向性
N2或CO sp和sp2 3 7 四面体 V字形 4 氢键的方向性
【解析】
(1)Cu为29号元素,位于第四周期ⅠB族;电子排布式为:1s22s22p63s23p63d104s1,当3d轨道电子为全满时,较为稳定,原子失去电子时,先失去4s上面的电子,则Cu+的电子排布式为1s22s22p63s23p63d10或[Ar]3d10;无水硫酸铜溶于水生成[Cu(H2O)4]SO4,其中呈蓝色的微粒为:[Cu(H2O)4]2+;向蓝色的硫酸铜溶液中滴加氨水至过量,溶液中生成深蓝色[Cu(NH3)4]SO4,[Cu(NH3)4]SO4在无水乙醇中溶解度较低,因此向[Cu(NH3)4]SO4溶液中加入无水乙醇后,[Cu(NH3)4]SO4会析出;
(2)![]() 电子式为:
电子式为:![]() ,
,
(3)CN-为双原子微粒,核外电子总数为(6+5+1)=12,与CN-互为等电子体的稳定微粒有N2、CO;
(4)![]() 中,碳碳双键上的碳原子为sp2杂化,
中,碳碳双键上的碳原子为sp2杂化,![]() 中C与N之间为三键,则C为sp杂化,
中C与N之间为三键,则C为sp杂化,
(5)碳碳双键中一根键为π键,碳氮三键中有2根键为π键,所以1mol丙烯腈含有3molπ键,
(6)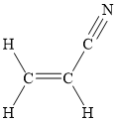 碳碳双键周边的6个原子共平面,碳碳三键上的碳原子以及直接相连的原子,共直线,现直线在碳碳双键的平面内,则所有原子均可以共平面,一共7个;
碳碳双键周边的6个原子共平面,碳碳三键上的碳原子以及直接相连的原子,共直线,现直线在碳碳双键的平面内,则所有原子均可以共平面,一共7个;
(7)H2O分子中价层电子对数为![]() ,故VSEPR模型为四面体;H2O的孤对电子对为
,故VSEPR模型为四面体;H2O的孤对电子对为![]() ,故分子立体构型为V字形;每个水分子都能缔合另外4 个水分子,形成四面体结构,所以水分子的配位数为4;因氢键具有方向性,是体积变大,使冰的密度比水小。
,故分子立体构型为V字形;每个水分子都能缔合另外4 个水分子,形成四面体结构,所以水分子的配位数为4;因氢键具有方向性,是体积变大,使冰的密度比水小。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L盐酸滴定25 mL 0.1000 mol/L Na2CO3溶液,滴定曲线如图。关于滴定过程中所得溶液相关微粒的浓度关系,下列说法正确的是
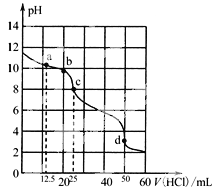
A.a点:c(CO32-)>c(HCO3-)>c(Cl-)
B.b点:5c(Cl-)>4c(HCO3-)+4c(CO32-)
C.c点:c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3)
D.d点:c(H+)=2c(CO32-)+c(HCO3-)+c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定量的CO2与足量的碳在体积可变的恒压密闭容器中反应:C(s)+CO2(g)2CO(g),平衡时,体系中气体体积分数与温度的关系如图所示,已知气体分压(P分)=气体总压(P总)×体积分数,下列说法不正确的是
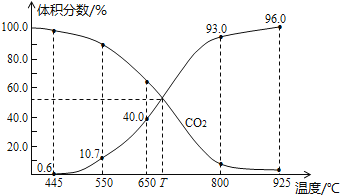
A.550℃时,若充入惰性气体,v正,v逆均减小
B.650℃时,反应达平衡后CO2的转化率为25.0%
C.T℃时,若充入等体积的CO2和CO,平衡向逆反应方向移动
D.925℃时,用平衡分压代替平衡浓度表示的化学平衡常数Kp=23.04P总
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分枝酸可用于生化研究。其结构简式如图。下列关于分枝酸的叙述正确的是

A. 分子中含有2种官能团
B. 可与乙醇、乙酸反应,且反应类型相同
C. 1mol分枝酸最多可与3molNaOH发生中和反应
D. 可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.05molL﹣1 KOH溶液滴定 10.00mL0.05molL﹣1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(体积变化忽略不计).下列说法错误的是( )
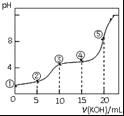
A.点②溶液中:c(K+)+c(H+)=c(HC2O4﹣)+c(C2O42﹣)+c(OH﹣)
B.点③溶液中:c(K+)=c(HC2O4﹣)+c(C2O42﹣)+c(H2C2O4)
C.点④溶液中:c(K+)+c(H2C2O4)+c(HC2O4﹣)+c(C2O42﹣)=0.05 molL﹣1
D.点⑤溶液中:c(K+)>c(HC2O4﹣)>c(C2O42﹣)>c(OH﹣)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铜可用于生产颜料、木材防腐剂等.用粗铜(含杂质Fe)经过系列步骤可制备氯化铜晶体(CuCl22H2O).完成下列填空:
(1)实验室用浓盐酸和二氧化锰共热来制备Cl2,写出该反应的离子方程式______.
(2)加入试剂将CuCl2和FeCl3的混合溶液pH调至4~5,过滤得到纯净的CuCl2溶液,应加入的试剂是__ (填字母编号)
a CuO b NaOH c Cu2(OH)2CO3 d Cu
(3)CuCl2溶液通过蒸发、结晶可得到CuCl22H2O.
①蒸发过程中,加入盐酸的目的是____.
②蒸发过程中,观察到溶液颜色由蓝色变为绿色.
其原理是:![]()

上述反应的化学平衡常数表达式是______.欲使溶液由绿色变成蓝色的措施是:a______;b______.
(4)由CuSO4溶液蒸发结晶得到CuSO45H2O的过程中不用加入硫酸,其原因是______(用勒夏特列原理解释).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】浓差电池是电化学电池的一种,主要部分包括正、负两个电极与电解质。一般所说的原电池在电池工作时都有某种化学变化发生,因而被称为化学电池;浓差电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,其净作用仅仅是一种物质从高浓度状态向低浓度状态的转移。如图是利用硫酸铜溶液构成的浓差电池的示意图,下列说法错误的是( )
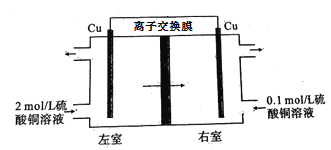
A.电池需采用阳离子交换膜
B.左室发生反应:Cu2++2e—=Cu
C.左室流出硫酸铜溶液物质的量浓度低于2 mol/L
D.工作一段时间后右室电极质量减轻
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
抗肿瘤新药黄酮醋酸是一种化学合成的黄酮类化合物。临床前研究表明黄酮醋酸对于许多移植性肿瘤,特别是实体瘤,具有明显的抑制活性。它的合成路线如下:
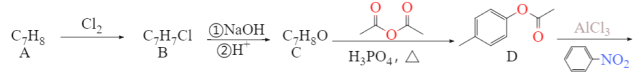
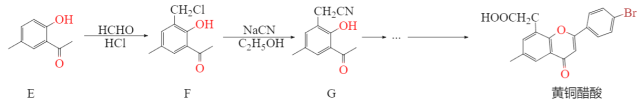
已知:RCN在酸性条件下发生水解反应:![]()
(1)A转化为B的反应条件是_______,写出B在一定条件下与NaOH 反应的化学方程式_______。
(2)有机物C的名称为_________,C转化为D的同时还生成了乙酸,写出反应的化学方程式_________。
(3)1 mol F最多可与_______ mol NaOH 反应。
(4)F转化为G的反应类型为__________,G的分子式为___,黄酮醋酸的含氧官能团有____(写官能团名称)。
(5)写出3个符合下列条件的E的同分异构体______。
①能发生银镜反应②遇FeCl3会发生显色反应③苯环上有4 种不同化学环境的氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用燃烧法测定某种氨基酸(CxHyOzNm)的分子组成。取Wg该种氨基酸放在纯氧中充分燃烧,生成二氧化碳、水和氮气。按下图所示装置进行实验。

回答下列问题:
(1)实验开始时,首先通入一段时间的氧气,其理由是__________________。
(2)以上装置中需要加热的仪器有_______ (填写字母),操作时应先点燃_____处的酒精灯。
(3)A装置中发生反应的化学方程式是____________________________。
(4)D装置的作用是____________________________。
(5)读取氮气的体积时,应注意①_________________;②_________________。
(6)实验中测得氮气的体积为VmL(标准状况),为确定此氨基酸的分子式,还需要的有关数据有____________________。
A.生成二氧化碳气体的质量
B.生成水的质量
C.通人氧气的体积
D.氨基酸的相对分子质量
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com