
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
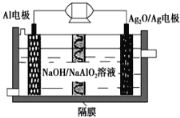
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C. Al电极做负极,电极反应式为:Al-3e-=Al3+
D. 工作时电解液中的Na+移向Ag2O/Ag电极
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】固定和利用CO2能有效地利用资源,并减少空气中的温室气体.工业上有一种用CO2来生产甲醇燃料的方法:
CO2(g)+3H2(g)CH3OH(g)+H2O(g)△H=﹣49.0kJmol﹣1
某科学实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如图所示(实线).
(1)a点正反应速率(填大于、等于或小于)逆反应速率.
(2)下列时间段平均反应速率最小的是 .
A.0~1min
B.1~3min
C.3~8min
D.8~11min
(3)求平衡时氢气的转化率和该条件下反应的平衡常数K.(写出计算过程)
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是 , 曲线II对应的实验条件改变是 . 判断的理由是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们常常利用化学反应中的能量变化为人类服务。
(1)氢能是一种具有发展前景的理想清洁能源,氢气燃烧时放出大量的热。氢气燃烧生成水蒸气的能量变化如下图所示:

根据上图可知,1molH2完全燃烧生成1molH2O(气态)时,释放的能量是___________kJ。
(2)下列化学反应在理论上可以设计成原电池的是___________。
A.Fe+2FeCl3=3FeCl2B.SO3+H2O=H2SO4
C.CH4+2O2![]() CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
CO2+2H2O D.Ba(OH)2+H2SO4=BaSO4+2H2O
(3)下图是某兴趣小组设计的原电池示意图,实验结束后,在实验报告上记录信息如下:

a.电流计指针偏转 |
b.Cu极有H2产生 |
c. H+向负极移动 |
d.电流由Zn经导线流向Cu |
①实验报告中记录合理的是___________(填序号)。
②请写出该电池的负极反应式___________。
③若有1mol电子流过导线,则理论上产生H2的质量为___________g。
④将稀H2SO4换成CuSO4溶液电极质量增加的是___________(填“锌极”或“铜极”, 下同), 溶液中SO42-移向___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气( 主要成分为甲烷)是一种高效的清洁能源,也是一种重要的化工原料,利用天然气制备甲醇、乙醇、二甲醚(CH3OCH3)、乙烯(C2H4)等物质的主要反应有:
①CH4(g)+H2O(g)=CO(g)+ 3H2(g) △H1= + 206.2 kJ/ mol
②CO(g)+2H2(g)=CH3OH(g) △H2=- 90.1kJ/ mol
③2CH3OH(g) = CH3OCH3(g) + H2O(g) △H3=- 24.5kJ/ mol
④2CH3OH(g) ![]() C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
C2H4(g) + 2H2O(g) △H4=- 29.1kJ/ mol
⑤CH3OCH3(g)== C2H5OH(g) △H5=- 50.7 kJ /mol
请回答下列问题:
(1)反应2CH4(g)+H2O(g)= C2H5OH(g)+2H2(g)的△H =______kJ/mol;根据化学原理,可 以同时加快该反应的速率和提高甲烷转化率的措施有_______________________。

(2)CO与H2在一定条件下,同时发生②和③的反应,产生二甲醚的结果如上图所示。260℃时,CO转化率虽然很高,而二甲醚的产率却很低,可能的原因是 ( 答出一条即可) _______;CO 与H2 合成二甲醚的最佳的温度是_____________。
(3) 对于气体参与的反应如反应④[2CH3OH(g) ![]() C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
C2H4(g) + 2H2O(g)],可以用某组分B的平衡压强(PB)代替物质的量浓度(c)表示平衡常数(Kp),则反应④的平衡常数表达式Kp=____;也可以用压强(PB)变化表示化学反应速率,体积不变的密闭容器中充入一定量的CH3OH气体发生反应④,在10分钟内,容器的压强由xkPa 升高到ykPa,则这段时间该反应的化学反应速率v(CH4)=_____________。
(4) 反应①~⑤中有多种物质可以做燃料电池的燃料,其中H2是单位质量燃料释放电能最多的物质,若与下列物质构成电池,H2 与_______构成的电池比能量最大。
a.H2O2 b.Cl2 C.O2 d.NiOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应一定属于放热反应的是( )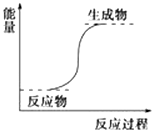
A.氢氧化钡晶体和氯化铵晶体的反应
B.能量变化如图所示的反应
C.化学键断裂吸收的能量比化学键形成放出的能量少的反应
D.不需要加热就能发生的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;

②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盐酸、硫酸和硝酸是中学阶段常见的“三大酸”.现就硫酸、硝酸与金属铜反应的情况,回答下列问题:
(1)工业上制备硫酸铜是利用废铜屑经灼烧后,在加热情况下跟稀硫酸反应,有关的化学方程式是: . 不采用铜跟浓硫酸反应来制取硫酸铜的原因是 .
(2)在一定体积的10molL﹣1的浓硫酸中加入过量铜片,加热使之反应,被还原的硫酸为0.9mol.则浓硫酸的实际体积(填“大于”、“等于”或“小于”)180mL.
(3)若使剩余的铜片继续溶解,可在其中加入硝酸盐溶液(如KNO3溶液),则该反应的离子方程式为 .
(4)将8g Fe2O3投入到150mL某浓度的稀硫酸中,再投入7g铁粉,充分反应后,收集到1.68L H2(标准状况),同时,Fe和Fe2O3均无剩余,为了中和过量的硫酸,且使溶液中铁元素完全沉淀,共消耗4molL﹣1的NaOH溶液150mL.则原硫酸的物质的量浓度为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z都是金属,把X浸入Z的硝酸盐溶液中,X的表面有Z析出,X和Y组成原电池时,Y为电池的负极.X、Y、Z三种金属的活动性顺序为( )
A.X>Y>Z
B.X>Z>Y
C.Y>X>Z
D.Y>Z>X
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com