
【题目】从能量的变化和反应的快慢等角度研究化学反应具有重要意义。
(1)已知一定条件下,反应N2+3H2![]() 2NH3为放热反应;:
2NH3为放热反应;:
①下图能正确表示该反应中能量变化的是________;

②根据下表数据,计算生成1molNH3时该反应放出的热量为______kJ;
化学键 | H-H | N≡N | N-H |
断开1mol键所吸收的能量 | 436kJ | 946kJ | 391kJ |
③一定温度下,将3molH2和1molN2通入容积为2 L的密闭容器中发生反应。若5min达到平衡,测得c(NH3)=0.4mol/L,则0至5min内N2的平均化学反应速率v(N2)=______,反应开始与平衡时气体的物质的量之比为__________;若达到平衡时,该容器内混合气体总压强为p,混合气体起始压强为p0 ,请用p0、p来表示达到平衡时H2的转化率为__________。
④ 在③反应条件下,能够判断该反应已经达到化学平衡状态的是______________。
A.容器内混合气体密度不变
B.混合气体的压强不变
C.单位时间内生成n mol N2 的同时生成2n mol NH3
D. v (N2)=2v(NH3)
(2)原电池可将化学能转化为电能。由A、B、C、D四种金属按下表中装置进行实验:

①装置甲中SO![]() 向________ 极移动(填“A”或“B”);
向________ 极移动(填“A”或“B”);
②四种金属活动性由强到弱的顺序是_____________;
③若装置丙中的电极为质量相等的铁棒和铜棒,电池工作一段时间后,取出洗净、干燥、称量,两电极质量差为6g,则导线中通过电子的物质的量为______mol。
【答案】A460.04moI/(L·min)5:4( 2P0-2P)/ P0BCAD>A>B>C0.1
【解析】
(1) ①反应物总能量比生成物总能量高的反应为放热反应,故选A; ②根据断开1mol化学键所吸收的能量进行计算反应热=946+3×436-6×391=-92kJ/mol,则反应生成1mol氨气放出的热量为46kJ。③用氨气计算反应速率为![]() mol/(L·min),根据氨气和氮气的化学计量数分析,氮气的反应速率表示为0.04mol/(L·min);根据化学方程式进行计算
mol/(L·min),根据氨气和氮气的化学计量数分析,氮气的反应速率表示为0.04mol/(L·min);根据化学方程式进行计算
N2+3H2![]() 2NH3
2NH3
起始物质的量浓度 0.5 1.5 0
改变物质的量浓度 0.2 0.6 0.4
平衡物质的量浓度 0.3 0.9 0.4
反应开始与平衡时气体的物质的量之比等于浓度比,等于(0.5+1.5):(0.3+0.9+0.4)=5:4;
N2+3H2![]() 2NH3
2NH3
起始物质的量浓度 0.5 1.5 0
改变物质的量浓度 x 3x 2x
平衡物质的量浓度0.5-x 1.5-3x 2x
则有(0.5-x+1.5-3x+2x)/(0.5+1.5)=P/ P0,计算x=(P0-P)/ P0,则氢气的转化率为{3(P0-P)/ P0}/1.5=(2P0-2P)/ P0; ④A.因为反应体系全为气体,容器的体积不变,所以密度始终不变,所以密度不变不能说明反应到平衡;B.反应前后气体的总物质的量改变,所以压强不变可以说明反应到平衡,故正确;C.说明的正反应速率和逆反应速率相等,反应到平衡,故正确;D.没有说明反应速率的方向,不能确定平衡,故错误。故选BC;(2)①装置甲B上有气体产生,说明该电极为正极,则溶液中的阴离子即硫酸根离子向负极移动,即向A电极移动,故选A;②装置甲中B上有气体产生,说明B为正极,则A比B活泼,装置乙中D不断溶解,说明D为负极,活动性比A强,装置丙中C的质量增加,说明其为正极,则B的活动性强于C,所以金属活动性由强到弱的顺序为D>A>B>C;③装置丙中,铁溶解,铜电极上析出铜单质,原来质量相等,电池工作一段时间后两电极质量差为6克,说明反应生成的铜和反应消耗的铁的质量差为6克,假设原电极的质量为mg,则有m+mCu-(m-mFe)=6,则有mCu+mFe=6,结合方程式分析,Fe+CuSO4=FeSO4+Cu,铁和铜的物质的量相等,则说明有0.05mol铁反应,转移电子为0.1mol。


 综合自测系列答案
综合自测系列答案科目:高中化学 来源: 题型:
【题目】人工光合作用能够借助太阳能,用CO2和H2O制备化学原料。下图是通过人工光合作用制备HCOOH的原理示意图,下列说法不正确的是
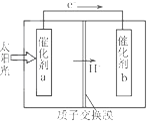
A. 该过程是将太阳能转化为化学能的过程
B. 催化剂a表面发生氧化反应,有O2产生
C. 催化剂a附近酸性减弱,催化剂b附近酸性增强
D. 催化剂b表面的反应是CO2+2H++2e一=HCOOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )

A. 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3
B. 金属性:A>C
C. 原子半径:C<D<E
D. 最外层电子数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Al-Ag2O电池是一种可用作水下动力的优良电源,其原理如图所示。该电池工作时总反应式为2Al+3Ag2O+2NaOH=2NaAlO2+6Ag+H2O,则下列说法错误的是 ( )
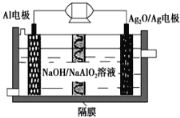
A. 工作时正极发生还原反应,且正极质量逐渐减小
B. 当电极上生成1.08 g Ag时,电路中转移的电子为0.01 mol
C. Al电极做负极,电极反应式为:Al-3e-=Al3+
D. 工作时电解液中的Na+移向Ag2O/Ag电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某镍冶炼车间排放的漂洗废水中含有一定浓度的Ni2+和Cl-,图甲是双膜三室电沉积法回收废水中Ni2+的示意图,图乙描述的是实验中阴极液pH与镍回收率之间的关系。下列说法不正确的是

A. 交换膜b为阴离子交换膜
B. 阳极反应式为2H2O-4e-=O2↑+4H+
C. 阴极液pH= 1时,镍的回收率低主要是有较多H2生成
D. 浓缩室得到1L 0.5 mol/L盐酸时,阴极回收得到11.8 g镍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的利用具有广阔前景.
(1)如图是从海水中提取镁的简单流程.

工业上常用于沉淀Mg2+的试剂A是______(填物质名称),Mg(OH)2转化为MgCl2的离子方程式是______.
(2)海带灰中富含以I﹣形式存在的碘元素。实验室提取I2的途径如下所示:
干海带![]() 海带灰
海带灰![]() 滤液
滤液![]()
![]()
![]() I2
I2
①灼烧海带至灰烬时所用的主要仪器名称是______.
②向酸化的滤液中加过氧化氢溶液,写出该反应的离子方程式______.
③反应结束后,加入CCl4作萃取剂,采用萃取﹣分液的方法从碘水中提取碘,主要操作步骤如图:

甲、乙、丙3步实验操作中,不正确的是______(填“甲”、“乙”或“丙”).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学兴趣小组在实验室里制备某些气体,并探究相关物质的性质,需要的仪器如下图所示,部分装置可重复选取。请回答下列问题:
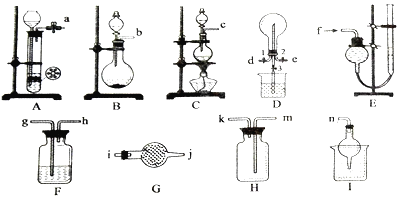
(1)制备并收集纯净的氨气。
①所选装置正确的连接顺序为_________________(填接口编号)。
②简述检验氨气的操作方法___________________________________________。
(2)氧气的制备及性质实验。
①制备装置中发生反应的离子方程式是_______________________。
②将纯净的氯气通入事先放入铁粉的两通硬质玻璃管中,加热制取三氯化铁(极易吸水),则在玻璃管右侧需要直接连接一个_____________装置。若将制得的三氯化铁配制成溶液,请简述操作方法____________________。
③可以用E装置收集并测量氯气的体积,其操作为___________。
(3)标准状况下,在D中可以发生反应3Cl2+2NH3=N2+6HCl。首先在烧瓶中收集满氯气,然后关闭止水夹1、3,打开止水夹2,通入NH3至上述反应恰好完全进行并关闭止水夹2。若此时仅打开止水夹3,D中烧瓶中的现象为____________,试计算烧瓶内所得溶液的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应2H2(g)+02(g)=2H2O(l)过程中的能量变化如图所示,下列有关说法中正确的是

A. H1<0 B. H2为该反应的反应热
C. H3为氢气的燃烧热 D. H1=H3-H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是( )

A. 电流从右侧电极经过负载后流向左侧电极
B. 负极发生的电极反应式为N2H4+4OH--4e-=N2↑+4H2O
C. 该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜必需选用阳离子交换膜
D. 该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com