
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�

��ҵ�ϳ����ڳ���Mg2+���Լ�A��______�����������ƣ���Mg��OH��2ת��ΪMgCl2�����ӷ���ʽ��______��
��2���������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��
�ɺ���![]() ������
������![]() ��Һ
��Һ![]()
![]()
![]() I2
I2
�����պ������ҽ�ʱ���õ���Ҫ����������______��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ______��
�۷�Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��

�ס��ҡ���3��ʵ������У�����ȷ����______����ס������ҡ���������
���𰸡� ʯ����������� Mg��OH��2+2H+=Mg2++2H2O ���� 2H++2I��+H2O2�TI2+2H2O ��
��������(1)��ҵ�ϳ���ʯ����������Ƴ���þ���ӣ� ������þ�����ᷴӦ�����Ȼ�þ��ˮ�����ӷ���ʽΪ��Mg��OH��2+2H+=Mg2++2H2O��(2) �����չ���ʱ���õ���Ҫ����Ϊ������ �� ���������Ӻ��������������Ϊ����������������ת��Ϊ���ʵ⣬���ӷ���ʽΪ��2H++2I��+H2O2�TI2+2H2O���������÷ֲ�ٳֺ�����������ʱ�����²�Һ����ϲ�Һ�壬���ͼ��������



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и���仯�У���ѧ��Ӧ�ġ�Hǰ��С�ں��ߵ�һ���ǣ�������
��CH4��g��+2O2��g���TCO2��g��+2H2O��l����H1��CH4��g��+2O2��g���TCO2��g��+2H2O��g����H2��
��S��s��+O2��g���TSO2��g����H1��S��g��+O2��g���TSO2��g����H2��
��2H2��g��+O2��g���T2H2O��l����H1��H2��g��+ ![]() O2��g���TH2O��l����H2��
O2��g���TH2O��l����H2��
��CaCO3��s���TCaO��s��+CO2��g����H1��CaO��s��+H2O��l���TCa��OH��2��s����H2 ��
A.�٢�
B.�ڢ�
C.�٢�
D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ȼ��( ��Ҫ�ɷ�Ϊ����)��һ�ָ�Ч�������Դ��Ҳ��һ����Ҫ�Ļ���ԭ�ϣ�������Ȼ���Ʊ��״����Ҵ���������(CH3OCH3)����ϩ(C2H4)�����ʵ���Ҫ��Ӧ�У�
��CH4(g)+H2O(g)=CO(g)+ 3H2(g) ��H1= + 206.2 kJ/ mol
��CO(g)+2H2(g)=CH3OH(g) ��H2=- 90.1kJ/ mol
��2CH3OH(g) = CH3OCH3(g) + H2O(g) ��H3=- 24.5kJ/ mol
��2CH3OH(g) ![]() C2H4(g) + 2H2O(g) ��H4=- 29.1kJ/ mol
C2H4(g) + 2H2O(g) ��H4=- 29.1kJ/ mol
��CH3OCH3(g)== C2H5OH(g) ��H5=- 50.7 kJ /mol
��ش��������⣺
(1)��Ӧ2CH4(g)+H2O(g)= C2H5OH(g)+2H2(g)����H =______kJ/mol�����ݻ�ѧԭ������ ��ͬʱ�ӿ�÷�Ӧ�����ʺ������ת���ʵĴ�ʩ��_______________________��

(2)CO��H2��һ�������£�ͬʱ�����ں͢۵ķ�Ӧ�����������ѵĽ������ͼ��ʾ��260��ʱ��COת������Ȼ�ܸߣ��������ѵIJ���ȴ�ܵͣ����ܵ�ԭ���� ( ���һ������) _______��CO ��H2 �ϳɶ����ѵ���ѵ��¶���_____________��
(3) �����������ķ�Ӧ�練Ӧ��[2CH3OH(g) ![]() C2H4(g) + 2H2O(g)]��������ij���B��ƽ��ѹǿ(PB)�������ʵ���Ũ��(c)��ʾƽ�ⳣ��(Kp)����Ӧ�ܵ�ƽ�ⳣ������ʽKp=____��Ҳ������ѹǿ(PB)�仯��ʾ��ѧ��Ӧ���ʣ����������ܱ������г���һ������CH3OH���巢����Ӧ�ܣ���10�����ڣ�������ѹǿ��xkPa ���ߵ�ykPa�������ʱ��÷�Ӧ�Ļ�ѧ��Ӧ����v(CH4)=_____________��
C2H4(g) + 2H2O(g)]��������ij���B��ƽ��ѹǿ(PB)�������ʵ���Ũ��(c)��ʾƽ�ⳣ��(Kp)����Ӧ�ܵ�ƽ�ⳣ������ʽKp=____��Ҳ������ѹǿ(PB)�仯��ʾ��ѧ��Ӧ���ʣ����������ܱ������г���һ������CH3OH���巢����Ӧ�ܣ���10�����ڣ�������ѹǿ��xkPa ���ߵ�ykPa�������ʱ��÷�Ӧ�Ļ�ѧ��Ӧ����v(CH4)=_____________��
(4) ��Ӧ�١������ж������ʿ�����ȼ�ϵ�ص�ȼ�ϣ�����H2�ǵ�λ����ȼ���ͷŵ����������ʣ������������ʹ��ɵ�أ�H2 ��_______���ɵĵ�ر��������
a.H2O2 b.Cl2 C.O2 d.NiOOH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���ѧ��Ӧ������Ҫ���塣
��1����֪һ�������£���ӦN2+3H2![]() 2NH3Ϊ���ȷ�Ӧ;��
2NH3Ϊ���ȷ�Ӧ;��
����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��

�ڸ����±����ݣ���������1molNH3ʱ�÷�Ӧ�ų�������Ϊ______kJ��
��ѧ�� | H-H | N��N | N-H |
�Ͽ�1mol�������յ����� | 436kJ | 946kJ | 391kJ |
��һ���¶��£���3molH2��1molN2ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����5min�ﵽƽ�⣬���c(NH3)=0.4mol/L����0��5min��N2��ƽ����ѧ��Ӧ����v(N2)=______����Ӧ��ʼ��ƽ��ʱ��������ʵ���֮��Ϊ__________�����ﵽƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0 ������p0��p����ʾ�ﵽƽ��ʱH2��ת����Ϊ__________��
�� �ڢ۷�Ӧ�����£��ܹ��жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����______________��
A�������ڻ�������ܶȲ���
B����������ѹǿ����
C����λʱ��������n mol N2 ��ͬʱ����2n mol NH3
D�� v (N2)��2v(NH3)
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���A��B��C��D���ֽ������±���װ�ý���ʵ�飺

��װ�ü���SO![]() ��________ ���ƶ����A����B������
��________ ���ƶ����A����B������
�����ֽ��������ǿ������˳����_____________��
����װ�ñ��еĵ缫Ϊ������ȵ�������ͭ������ع���һ��ʱ���ȡ��ϴ����������������缫������Ϊ6g��������ͨ�����ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ƾ���ǿ�����ԣ���ľ̿�����۵Ȼ�ԭ������ʱ��ȼ�գ������й�˵������ȷ���ǣ�������
A.Na2O2��CO2��Ӧʱ��Na2O2����������CO2�ǻ�ԭ��
B.1mol������������������ĿΪ1NA
C.����������ľ̿�����۷�Ӧʱ���������ƾ����ֳ�ǿ������
D.�����������������Ӧʱ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ�������������ѧ�γ����ġ������ᡱ���־����ᡢ���������ͭ��Ӧ��������ش��������⣺
��1����ҵ���Ʊ�����ͭ�����÷�ͭм�����պ��ڼ�������¸�ϡ���ᷴӦ���йصĻ�ѧ����ʽ�ǣ� �� ������ͭ��Ũ���ᷴӦ����ȡ����ͭ��ԭ���� ��
��2����һ�������10molL��1��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ�����������ڡ��������ڡ���С�ڡ���180mL��
��3����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ����KNO3��Һ������÷�Ӧ�����ӷ���ʽΪ ��
��4����8g Fe2O3Ͷ�뵽150mLijŨ�ȵ�ϡ�����У���Ͷ��7g���ۣ���ַ�Ӧ���ռ���1.68L H2����״������ͬʱ��Fe��Fe2O3����ʣ�࣬Ϊ���к��������ᣬ��ʹ��Һ����Ԫ����ȫ������������4molL��1��NaOH��Һ150mL����ԭ��������ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ������������ԭ��Ӧ���������ȷ�Ӧ���ǣ� ��
A.��Ƭ��ϡ����ķ�Ӧ
B.���ȵ�̿��CO2�ķ�Ӧ
C.Ba��OH��28H2O��NH4Cl�ķ�Ӧ
D.�����������е�ȼ�շ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼���γɻ�������������Ԫ�أ��䵥�ʼ������������������������Ҫ��Դ���ʣ���ش��������⣺
��1���л���M����̫������տ�ת����N��ת���������£� 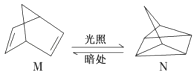
��H=+88.6kJ/mol����M��N��ȣ����ȶ����� ��
��2����֪CH3OH��l����ȼ���ȡ�H=��238.6kJ/mol��CH3OH��l��+ ![]() O2��g���TCO2��g��+2H2��g����H=��a kJ/mol����a238.6���������������=������
O2��g���TCO2��g��+2H2��g����H=��a kJ/mol����a238.6���������������=������
��3��ʹCl2��H2O��g��ͨ�����ȵ�̿�㣬����HCl��CO2 �� ����1mol Cl2���뷴Ӧʱ�ͷų�145kJ������д���÷�Ӧ���Ȼ�ѧ����ʽ�� ��
��4������͵�������ı������������ʣ���ʯī�����ۺͶ������Ѱ�һ����������ڸ��������գ��������ʿ������²��ϣ�4Al��s��+3TiO2��s��+3C��s���T2Al2O3��s��+3TiC��s����H=��1176kJ/mol����Ӧ�����У�ÿת��1mol���ӷų�������Ϊ ��
��5�������ų���β���к���CO��NO�����壮Ϊ�˽����Ⱦ���⣬�������������ڰ�װ�Ĵ�ת��������ʹ����β���е���Ҫ��Ⱦ��CO��NOת��Ϊ���Ĵ���ѭ�����ʣ���֪�� N2��g��+O2��g���T2NO��g����H=+180.5kJ/mol
2C��s��+O2��g���T2CO��g����H=��221.0kJ/mol
C��s��+O2��g���TCO2��g����H=��393.5kJ/mol
��д����Ⱦ��CO��NOת��Ϊ���Ĵ���ѭ�����ʵ��Ȼ�ѧ����ʽ�ǣ� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com