
����Ŀ�����ᡢ�������������ѧ�γ����ġ������ᡱ���־����ᡢ���������ͭ��Ӧ��������ش��������⣺
��1����ҵ���Ʊ�����ͭ�����÷�ͭм�����պ��ڼ�������¸�ϡ���ᷴӦ���йصĻ�ѧ����ʽ�ǣ� �� ������ͭ��Ũ���ᷴӦ����ȡ����ͭ��ԭ���� ��
��2����һ�������10molL��1��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ�����������ڡ��������ڡ���С�ڡ���180mL��
��3����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ����KNO3��Һ������÷�Ӧ�����ӷ���ʽΪ ��
��4����8g Fe2O3Ͷ�뵽150mLijŨ�ȵ�ϡ�����У���Ͷ��7g���ۣ���ַ�Ӧ���ռ���1.68L H2����״������ͬʱ��Fe��Fe2O3����ʣ�࣬Ϊ���к��������ᣬ��ʹ��Һ����Ԫ����ȫ������������4molL��1��NaOH��Һ150mL����ԭ��������ʵ���Ũ��Ϊ ��
���𰸡�
��1��2Cu+O2 ![]() 2CuO��CuO+H2SO4=CuSO4+H2O,���ɵ���������ͭ������϶�,�����ɵĶ���������Ⱦ����
2CuO��CuO+H2SO4=CuSO4+H2O,���ɵ���������ͭ������϶�,�����ɵĶ���������Ⱦ����
��2������
��3��3Cu+2NO3��+8H+�T3Cu2++2NO��+4H2O
��4��2mol/L
���������⣺��1�����������£�Cu��������Ӧ����CuO����Ӧ����ʽΪ��2Cu+O2 ![]() 2CuO��CuO��ϡ���ᷴӦ����ʽΪCuO+H2SO4
2CuO��CuO��ϡ���ᷴӦ����ʽΪCuO+H2SO4 ![]() CuSO4+H2O��Ũ�����ͭ��Ӧ����ʽΪ��Cu+2H2SO4��Ũ��
CuSO4+H2O��Ũ�����ͭ��Ӧ����ʽΪ��Cu+2H2SO4��Ũ�� ![]() CuSO4+SO2+2H2O�����ɵ���������ͭʱ��Ҫ����϶������ɵĶ���������Ⱦ������
CuSO4+SO2+2H2O�����ɵ���������ͭʱ��Ҫ����϶������ɵĶ���������Ⱦ������
���Դ��ǣ�2Cu+O2 ![]() 2CuO��CuO+H2SO4=CuSO4+H2O�����ɵ���������ͭ������϶࣬�����ɵĶ���������Ⱦ������
2CuO��CuO+H2SO4=CuSO4+H2O�����ɵ���������ͭ������϶࣬�����ɵĶ���������Ⱦ������
��2���ڼ��������£�Ũ�����ͭ��Ӧ���ɶ�������ϡ�����ͭ����Ӧ����Ũ����Ũ�ȴﵽһ��ֵ���Ϊϡ���ᣬϡ�����ͭ����Ӧ�����Ա���ԭ������Ϊ0.9mol����Ũ�����ʵ���������180mL��
���Դ��ǣ����ڣ�
��3�������������£���������Ӻ�ͭ����������ԭ��Ӧ��������ͭ��NO���������ӷ�Ӧ����ʽΪ��3Cu+2NO3��+8H+�T3Cu2++2NO��+4H2O��
���Դ��ǣ�3Cu+2NO3��+8H+�T3Cu2++2NO��+4H2O��
��4���ù����з����ķ�ӦΪ��Fe2O3+3H2SO4=Fe2��SO4��3+3H2O��Fe+H2SO4=FeSO4+H2��Fe2��SO4��3+Fe=3FeSO4��FeSO4+2NaOH=Fe��OH��2��+Na2SO4��2NaOH+H2SO4=Na2SO4+2H2O��������Һ�е�������Na2SO4��ԭ���غ�� ![]() n��NaOH��=n��Na2SO4��=n��H2SO4������c��H2SO4��=
n��NaOH��=n��Na2SO4��=n��H2SO4������c��H2SO4��= ![]() =
= ![]() =2 molL��1��
=2 molL��1��
���Դ��ǣ�2mol/L��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��һ����ѧ���̵�ʾ��ͼ����֪�׳ص��ܷ�ӦʽΪ��2CH3OH+3O2+4KOH�T2K2CO3+6H2O��
��1���׳���װ�ã�
��2���ҳ���A��ʯī���缫�������� ��
��3��д��ͨ��CH3OH�ĵ缫�ĵ缫��Ӧʽ�� ��
��4���ҳ��з�Ӧ�Ļ�ѧ����ʽΪ ��
��5�����ҳ���B��Ag��������������5.40gʱ���׳�������������O2 mL����״��������ʱ����ij�缫������1.60gij������������е�ij����Һ������������ţ���
A��MgSO4�� B��CuSO4 C��NaCl�� D��AgNO3 ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Al��Ag2O�����һ�ֿ�����ˮ�¶�����������Դ����ԭ����ͼ��ʾ���õ�ع���ʱ�ܷ�ӦʽΪ2Al��3Ag2O��2NaOH=2NaAlO2��6Ag��H2O��������˵��������� (����)
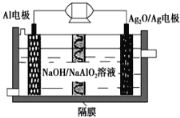
A. ����ʱ����������ԭ��Ӧ��������������С
B. ���缫������1.08 g Agʱ����·��ת�Ƶĵ���Ϊ0.01 mol
C. Al�缫���������缫��ӦʽΪ��Al��3e��=Al3+
D. ����ʱ���Һ�е�Na������Ag2O/Ag�缫
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Դ�����þ��й���ǰ����
��1����ͼ�ǴӺ�ˮ����ȡþ�ļ����̣�

��ҵ�ϳ����ڳ���Mg2+���Լ�A��______�����������ƣ���Mg��OH��2ת��ΪMgCl2�����ӷ���ʽ��______��
��2���������и�����I����ʽ���ڵĵ�Ԫ�ء�ʵ������ȡI2��;��������ʾ��
�ɺ���![]() ������
������![]() ��Һ
��Һ![]()
![]()
![]() I2
I2
�����պ������ҽ�ʱ���õ���Ҫ����������______��
�����ữ����Һ�мӹ���������Һ��д���÷�Ӧ�����ӷ���ʽ______��
�۷�Ӧ��������CCl4����ȡ����������ȡ����Һ�ķ����ӵ�ˮ����ȡ�⣬��Ҫ����������ͼ��

�ס��ҡ���3��ʵ������У�����ȷ����______����ס������ҡ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ��ȤС����ʵ�������Ʊ�ijЩ���壬��̽��������ʵ����ʣ���Ҫ����������ͼ��ʾ������װ�ÿ��ظ�ѡȡ����ش��������⣺
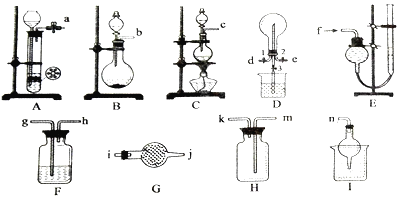
��1���Ʊ����ռ������İ�����
����ѡװ����ȷ������˳��Ϊ_________________(��ӿڱ��)��
���������鰱���IJ�������___________________________________________��
��2���������Ʊ�������ʵ�顣
���Ʊ�װ���з�����Ӧ�����ӷ���ʽ��_______________________��
��������������ͨ�����ȷ������۵���ͨӲ�ʲ������У�������ȡ���Ȼ���(������ˮ),���ڲ������Ҳ���Ҫֱ������һ��_____________װ�á������Ƶõ����Ȼ������Ƴ���Һ���������������____________________��
��������Eװ���ռ����������������,�����Ϊ___________��
��3����״���£���D�п��Է�����Ӧ3Cl2+2NH3=N2+6HCl����������ƿ���ռ�������,Ȼ��ر�ֹˮ��1��3,��ֹˮ��2��ͨ��NH3��������Ӧǡ����ȫ���в��ر�ֹˮ��2������ʱ����ֹˮ��3,D����ƿ�е�����Ϊ____________���Լ�����ƿ��������Һ�����ʵ���Ũ��Ϊ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£����ȵ�����ˮ������һ������ɱ���ܱ������н��з�Ӧ:3Fe(s)+4H2O(g)![]() Fe3O4(s)+4H2(g)�����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
Fe3O4(s)+4H2(g)�����������ĸı���䷴Ӧ���ʼ�����Ӱ�����
A. ����H2���� B. �����¶�
C. ѹǿ���䣬���뵪��ʹ����������� D. ������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����Ӧ2H2(g)+02(g)=2H2O(l)�����е������仯��ͼ��ʾ�������й�˵������ȷ����

A. H1<0 B. H2Ϊ�÷�Ӧ�ķ�Ӧ��
C. H3Ϊ������ȼ���� D. H1=H3-H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����ӵ�������ֵ������˵����ȷ���ǣ� ��
A. ��״���£���6.72L��NO2ͨ��������ˮ��ת�Ƶ�����Ϊ0.3NA
B. ���³�ѹ�£�22.4LCCl4����NA��CCl4����
C. 1 mol Na������O2��Ӧ������Na2O��Na2O2����ת�Ƶĵ�����ΪNA
D. 18 g D2O�����ĵ�����Ϊ10NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ȼ�ϵ���Ƿ�����ɫ��ѧ��������ͷ���װ�á���ͼΪ���ʾ��ͼ���õ�ص缫�����һ��ϸС�IJ��ۣ����������������ǿ�������ȶ�����ش�

(1)������ӦʽΪ__________________________��������ӦʽΪ___________________________��
(2)�õ�ع���ʱ��H2��O2�������ⲿ��������ؿ��������ϵ��ṩ���ܡ���ˣ�������ȫ�����ǹؼ�����֮һ���������һ����Ҫ�Ĵ�����ϣ�������ͷ���ԭ�����£�
��2Li+H2![]() 2LiH
2LiH
��LiH+H2O=LiOH+H2��
�ٷ�Ӧ���е���������___________________��
����֪LiH�����ܶ�Ϊ0.80g��cm-3���������112L(��״����)H2�����ɵ�LiH����뱻���յ�H2�����Ϊ_______________(���÷�����ʾ����a��10-b��ʾ��a������λС��);
���ɢ����ɵ�LiH��H2O���ã��ų���H2�������ȼ�ϣ�������ת����Ϊ60%��������ͨ�����ӵ����ʵ���Ϊ_______________mol��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com