
����Ŀ����ѧ��ȤС����ʵ�������Ʊ�ijЩ���壬��̽��������ʵ����ʣ���Ҫ����������ͼ��ʾ������װ�ÿ��ظ�ѡȡ����ش��������⣺
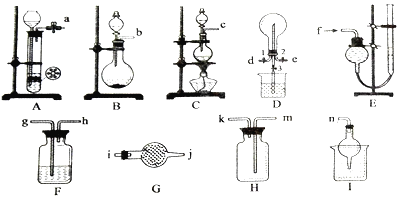
��1���Ʊ����ռ������İ�����
����ѡװ����ȷ������˳��Ϊ_________________(��ӿڱ��)��
���������鰱���IJ�������___________________________________________��
��2���������Ʊ�������ʵ�顣
���Ʊ�װ���з�����Ӧ�����ӷ���ʽ��_______________________��
��������������ͨ�����ȷ������۵���ͨӲ�ʲ������У�������ȡ���Ȼ���(������ˮ),���ڲ������Ҳ���Ҫֱ������һ��_____________װ�á������Ƶõ����Ȼ������Ƴ���Һ���������������____________________��
��������Eװ���ռ����������������,�����Ϊ___________��
��3����״���£���D�п��Է�����Ӧ3Cl2+2NH3=N2+6HCl����������ƿ���ռ�������,Ȼ��ر�ֹˮ��1��3,��ֹˮ��2��ͨ��NH3��������Ӧǡ����ȫ���в��ر�ֹˮ��2������ʱ����ֹˮ��3,D����ƿ�е�����Ϊ____________���Լ�����ƿ��������Һ�����ʵ���Ũ��Ϊ___________��
���𰸡� b(c)��i��j��k��m(��i��j)��n ��ʪ��ĺ�ɫʯ����ֽ(��pH��ֽ)������Ӵ�,����ֽ����˵���ǰ������������� MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O ���� ��FeCl3�����ܽ������������У�Ȼ�������ˮϡ����������� ��������Һ����ƽ,�������ռ�������,�ٴε�������Һ����ƽ������,���ζ�����ֵ��Ϊ���ռ���������� ����Ȫ����,��Һ���Լռ��ƿ�ݻ���2/3
Mn2++Cl2��+2H2O ���� ��FeCl3�����ܽ������������У�Ȼ�������ˮϡ����������� ��������Һ����ƽ,�������ռ�������,�ٴε�������Һ����ƽ������,���ζ�����ֵ��Ϊ���ռ���������� ����Ȫ����,��Һ���Լռ��ƿ�ݻ���2/3 ![]() mol��L-1��0.134mol��L-1��0.13mol��L-1
mol��L-1��0.134mol��L-1��0.13mol��L-1
����������1����ʵ�����Ʊ����������Ȼ�粒�������ʯ�Ҽ��ȷ�Ӧ����Ũ��ˮ����ʯ�ҷ�Ӧ�����ɵİ����к���ˮ��������Ҫ�ü�ʯ�������������ռ�Ϊ�����ſ�������β��������ע���ֹ������������ȷ�𰸣�b(c)��i��j��k��m(��i��j)��n��
��������ˮ��Һ�Լ�������ʪ��ĺ�ɫʯ����ֽ(��pH��ֽ)������Ӵ�,����ֽ����˵���ǰ�������պ��Ũ����IJ������ӽ����壬ð���̣���ȷ��ͬ�ϣ�
��2���������Ʊ�������ʵ�顣
��ʵ�����Ʊ��������ö���������Ũ������ȷ�Ӧ�Ʊ�����ȷ�𰸣�MnO2+4H++2Cl-![]() Mn2++Cl2��+2H2O��
Mn2++Cl2��+2H2O��
�����Ȼ���������ˮ���������Ҳ���Ҫֱ������һ��װ�м�ʯ�ҵĸ���װ�ã�������ˮ���������ն�������������Ȼ�����ˮ������ˮ�⣬Ϊ��ֹ����ˮ�⣬��FeCl3�����ܽ������������У�Ȼ�������ˮϡ���������������ȷ�𰸣����� ����FeCl3�����ܽ������������У�Ȼ�������ˮϡ�������������
��������ͨ��ԭ����ʹ����Һ���ռ�������Ȼ���������Һ����ƽ���������ռ���������ȴ�����£��ٴε�������Һ����ƽ�����������ζ�����ֵ��Ϊ���ռ������������ ��ȷ������������Һ����ƽ���������ռ����������ٴε�������Һ����ƽ�����������ζ�����ֵ��Ϊ���ռ������������
��3����ӦΪ3Cl2+2NH3=N2+6HCl���Ȼ��⼫������ˮ����ƿ�������ѹǿѸ�ټ��٣���ѹ������ѹ������ʱ����ֹˮ��3��D����ƿ������Ȫ���ɣ���ƿ����Һ���������������Լռ��ƿ�ݻ���2/3����ƿ��������ҺΪ��ˮ������ƿ���ΪVL,���ݷ�Ӧ��ϵ����ϵ�����������ʵ���ΪV/22.4mol,�������ʵ���ΪV/11.2mol, ������Һ�����Ϊռ������ƿ�����2V/3L��������Һ��Ũ��Ϊ��V��11.2��/2V/3= ![]() mol��L-1����ȷ��������Ȫ��������Һ���Լռ��ƿ�ݻ���2/3 ��
mol��L-1����ȷ��������Ȫ��������Һ���Լռ��ƿ�ݻ���2/3 �� ![]() mol��L-1��0.134mol��L-1��0.13mol��L-1��
mol��L-1��0.134mol��L-1��0.13mol��L-1��


 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������������ȷ���ǣ� ��
A. ���������һ�ȴ�����4��
B. �ױ���C7H8�����ͣ�C3H8O3�����������������ϣ���������һ��ʱ�����ȼ������ˮ�������Dz����
C. ij���Ľṹ��ʽ�ɱ�ʾΪ![]() ��̼ԭ������10������֪�������������ֻ�ѧ���� ��ͬ����ԭ�ӣ������һ���DZ���ͬϵ��
��̼ԭ������10������֪�������������ֻ�ѧ���� ��ͬ����ԭ�ӣ������һ���DZ���ͬϵ��
D. ����ʽΪC5H10O2���л���ֻ�ܺ���һ�ֹ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧһ�����ڷ��ȷ�Ӧ���ǣ�������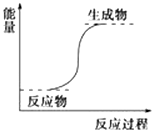
A.��������������Ȼ�茶���ķ�Ӧ
B.�����仯��ͼ��ʾ�ķ�Ӧ
C.��ѧ���������յ������Ȼ�ѧ���γɷų��������ٵķ�Ӧ
D.����Ҫ���Ⱦ��ܷ����ķ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ı仯�ͷ�Ӧ�Ŀ����ȽǶ��о���ѧ��Ӧ������Ҫ���塣
��1����֪һ�������£���ӦN2+3H2![]() 2NH3Ϊ���ȷ�Ӧ;��
2NH3Ϊ���ȷ�Ӧ;��
����ͼ����ȷ��ʾ�÷�Ӧ�������仯����________��

�ڸ����±����ݣ���������1molNH3ʱ�÷�Ӧ�ų�������Ϊ______kJ��
��ѧ�� | H-H | N��N | N-H |
�Ͽ�1mol�������յ����� | 436kJ | 946kJ | 391kJ |
��һ���¶��£���3molH2��1molN2ͨ���ݻ�Ϊ2 L���ܱ������з�����Ӧ����5min�ﵽƽ�⣬���c(NH3)=0.4mol/L����0��5min��N2��ƽ����ѧ��Ӧ����v(N2)=______����Ӧ��ʼ��ƽ��ʱ��������ʵ���֮��Ϊ__________�����ﵽƽ��ʱ���������ڻ��������ѹǿΪp�����������ʼѹǿΪp0 ������p0��p����ʾ�ﵽƽ��ʱH2��ת����Ϊ__________��
�� �ڢ۷�Ӧ�����£��ܹ��жϸ÷�Ӧ�Ѿ��ﵽ��ѧƽ��״̬����______________��
A�������ڻ�������ܶȲ���
B����������ѹǿ����
C����λʱ��������n mol N2 ��ͬʱ����2n mol NH3
D�� v (N2)��2v(NH3)
��2��ԭ��ؿɽ���ѧ��ת��Ϊ���ܡ���A��B��C��D���ֽ������±���װ�ý���ʵ�飺

��װ�ü���SO![]() ��________ ���ƶ����A����B������
��________ ���ƶ����A����B������
�����ֽ��������ǿ������˳����_____________��
����װ�ñ��еĵ缫Ϊ������ȵ�������ͭ������ع���һ��ʱ���ȡ��ϴ����������������缫������Ϊ6g��������ͨ�����ӵ����ʵ���Ϊ______mol��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ����٤��������ֵ������˵����ȷ���ǣ�������
A.4 g�����к��еķ�������ԭ������ΪNA
B.��״���£�22.4 L CCl4�к��еķ�����ΪNA
C.1 L 0.1 molL��1�Ҵ���Һ�к��е���ԭ����Ϊ0.1NA
D.1 mol Cl2��ȫ��Ӧת�Ƶĵ�����һ����2NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ᡢ�������������ѧ�γ����ġ������ᡱ���־����ᡢ���������ͭ��Ӧ��������ش��������⣺
��1����ҵ���Ʊ�����ͭ�����÷�ͭм�����պ��ڼ�������¸�ϡ���ᷴӦ���йصĻ�ѧ����ʽ�ǣ� �� ������ͭ��Ũ���ᷴӦ����ȡ����ͭ��ԭ���� ��
��2����һ�������10molL��1��Ũ�����м������ͭƬ������ʹ֮��Ӧ������ԭ������Ϊ0.9mol����Ũ�����ʵ�����������ڡ��������ڡ���С�ڡ���180mL��
��3����ʹʣ���ͭƬ�����ܽ⣬�������м�����������Һ����KNO3��Һ������÷�Ӧ�����ӷ���ʽΪ ��
��4����8g Fe2O3Ͷ�뵽150mLijŨ�ȵ�ϡ�����У���Ͷ��7g���ۣ���ַ�Ӧ���ռ���1.68L H2����״������ͬʱ��Fe��Fe2O3����ʣ�࣬Ϊ���к��������ᣬ��ʹ��Һ����Ԫ����ȫ������������4molL��1��NaOH��Һ150mL����ԭ��������ʵ���Ũ��Ϊ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵���д�����ǣ� ��
A.���й��ۼ��Ļ�����һ���ǹ��ۻ�����
B.�ڹ��ۻ�������һ�����й��ۼ�
C.�������Ӽ��Ļ�����һ�������ӻ�����
D.���ӻ������п��ܺ��й��ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��Ԫ�����ڱ���һ���֣�����������ĸa��b��c��d��e��f��g��h�ֱ����ij�ֻ�ѧԪ�ء���������8��Ԫ�ػش��������⡣

(1)����8��Ԫ�صĵ����г�����Ϊ��̬�����ܶ���С����______(�ѧʽ)��
(2)fԪ�ص�ԭ�ӽṹʾ��ͼΪ_______��
(3)c������������Ӧˮ����Ļ�ѧʽΪ______��
(4)hg�ĵ���ʽΪ_______��
(5)b��c��d����Ԫ�ص�����⻯��ķе��ɸߵ��͵�˳����______(�ѧʽ)��
(6)Ԫ��e�ĵ�����h������������Ӧ��ˮ���ﷴӦ�Ļ�ѧ����ʽΪ__________��
(7)fԪ�ص�����⻯���ˮ��Һ��____��(��ᡱ�)����д�����⻯������ڿ����б��ʵĻ�ѧ����ʽ________��
(8)gd-��������������������(As)�ڼ�����Һ�пɱ�gd-����ΪAsO43-���÷�Ӧ�����ӷ���ʽΪ__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л�ѧ������ȷ���ǣ�������
A.������Ľṹ��ʽ��C5H12
B.����ı���ģ�ͣ� 
C.���Ȼ�̼�ĵ���ʽ�� 
D.��ϩ�Ľṹʽ�� 
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com