
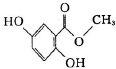
| H2O2 |
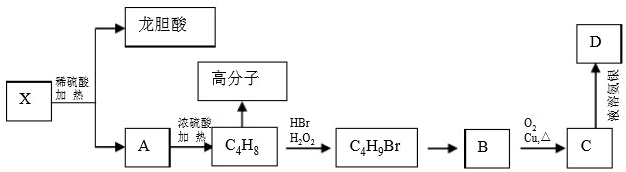
 ,所以1mol龙胆酸甲酯能消耗3mol氢氧化钠,故答案为:3mol;
,所以1mol龙胆酸甲酯能消耗3mol氢氧化钠,故答案为:3mol;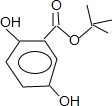 或
或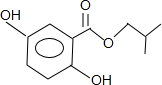 ;A发生消去反应生成烯烃C4H8,C4H8为纯净物且含支链,应为(CH3)2C=CH2,则A为(CH3)3COH或(CH3)2CHCH2OH,B为即为(CH3)2CHCH2OH,B中有5种不同环境的H原子,B的核磁共振氢谱中应有5种吸收峰,
;A发生消去反应生成烯烃C4H8,C4H8为纯净物且含支链,应为(CH3)2C=CH2,则A为(CH3)3COH或(CH3)2CHCH2OH,B为即为(CH3)2CHCH2OH,B中有5种不同环境的H原子,B的核磁共振氢谱中应有5种吸收峰, 或
或 ;消去反应;5;
;消去反应;5;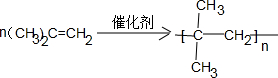 ;B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,B→C是发生醇的催化氧化,反应方程式为:2(CH3)2CHCH2OH+O2
;B为(CH3)2CHCH2OH,C为(CH3)2CHCHO,B→C是发生醇的催化氧化,反应方程式为:2(CH3)2CHCH2OH+O2| Cu |
| △ |
 ;2(CH3)2CHCH2OH+O2
;2(CH3)2CHCH2OH+O2| Cu |
| △ |
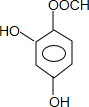 ,以及和酯基对位的酚羟基在3、5、6三个位置,共4种,还有
,以及和酯基对位的酚羟基在3、5、6三个位置,共4种,还有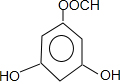 ,以及将其中一个酚羟基连在酯基的对位,共2种,总共6种,故答案为:6种.
,以及将其中一个酚羟基连在酯基的对位,共2种,总共6种,故答案为:6种.


科目:高中化学 来源: 题型:
| A、20℃时,饱和KCl溶液与等质量的水混合后物质的量浓度大于2.0mol?L-1 |
| B、20℃时,将29.8 gKCl溶于87.6g水中可得饱和溶液 |
| C、20℃时,密度小于1.174g?cm-3的KCl溶液是不饱和溶液 |
| D、将此溶液蒸发部分水,再恢复到20℃时,溶液中各离子的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用乙醇或CCl4均可提取碘水中的碘单质 |
| B、NaCl和SiC晶体熔化时,克服粒子间作用力的类型相同 |
| C、二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| D、24Mg32S晶体中电子总数与中子总数之比为1:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com