
| ||
| 168g×6.2g |
| 62g |
| 106g×6.2g |
| 62g |
| 106g×4.48L |
| 22.4L |
| 10.6g |
| 40g |


科目:高中化学 来源: 题型:
| A、体积相等时质量一定相等 |
| B、电子数相等时具有相等的原子数 |
| C、同温同压下质子数相等则体积相等 |
| D、质量相等时具有相等的分子数 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |
查看答案和解析>>
科目:高中化学 来源: 题型:
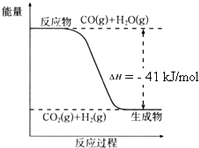 (1)根据如图写出热化学方程式:
(1)根据如图写出热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
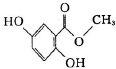
| H2O2 |
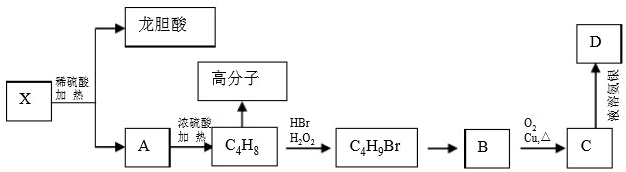
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com