
| 名称 | 托盘天平(带砝码) | 小烧杯 | 坩埚钳 | 玻璃棒 | 药匙 | 量筒 |
| 仪器 |  |
 |
 |
 |
 |
 |
| 序号 | a | b | c | d | e | f |
| n |
| V |
| n |
| V |


科目:高中化学 来源: 题型:
| A、11.2升 |
| B、67.2升 |
| C、4.48升 |
| D、33.6升 |
查看答案和解析>>
科目:高中化学 来源: 题型:
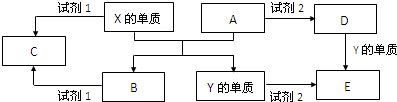
查看答案和解析>>
科目:高中化学 来源: 题型:
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为5%的葡萄糖(C6H12O6)注射液标签,请认真观察标签查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| A | 原子核外有6种不同运动状态的电子 |
| C | 基态原子中s电子总数与p电子总数相等 |
| D | 原子半径在同周期元素中最大 |
| E | 基态原子最外层电子排布式为3s23p1 |
| F | 基态原子的最外层p轨道有两个电子的自旋方向与其它电子的自旋方向相反 |
| G | 基态原子核外有7个能级且能量最高的能级上有6个电子 |
| H | 是我国使用最早的合金中的最主要元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不变 | B、增大 |
| C、减小 | D、无法判断 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com