
【题目】下列物质中,不能发生水解反应的是( )
A.乙醇B.纤维素C.麦芽糖D.高级脂肪酸甘油酯
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】请根据表中的信息回答下列问题
元素 | A | B | C | D | E |
有关信息 | 其原子核内只有1个质子 | 其单质在空气中体积含量最多 | 其原子M层有3个电子 | 食盐中的金属元素 | 单质在常温、常压下是黄绿色的气体 |
(1)D离子的结构示意图:________,B原子的电子式:________,E离子的电子式:________。
(2)和B元素的氢化物所含电子数相同的分子有多种,写出任意2种:________,________。
(3)A元素与E元素组成的化合物的电离方程式:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知: 25℃、101 kPa下:① 2 Na(s) + 1/2 O2(g) = Na2O(s) △H1 = - 414 kJ / mol
② 2 Na(s) + O2(g) = Na2O2(s) △H2 = - 511 kJ / mol
下列说法正确的是
A. ①和②产物的阴阳离子个数比不相等
B. ①和②生成等物质的量的产物,转移电子数不同
C. 常温下Na与足量O2反应生成Na2O,随温度升高生成Na2O的速率逐渐加快
D. 25℃、101 kPa下,Na2O2(s) + 2 Na(s) = 2 Na2O(s) △H = -317 kJ / mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某结晶水合物的化学式为R·nH2O,其相对分子质量为M。25℃时,将ag该晶体溶于bg水中恰好可形成VmL饱和溶液。下列关系中正确的是( )
A. 饱和溶液的物质的量浓度为![]() mol·L-1
mol·L-1
B. 饱和溶液中溶质的质量分数为![]() %
%
C. 25℃时R的溶解度为![]() g
g
D. 饱和溶液的密度为![]() g·L-1
g·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.5.85g氯化钠所含的离子数为0.1NA
B.2.8gN2中含有共用电子对的数目为0.1NA
C.0.1molF2中含有共价键的数目为0.2NA
D.0.1molH2与Cl2的混合气体充分反应后体系中含有共价键数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒是一种重要的金属材料,其用途之一是制备催化剂,如接触法生产硫酸中使用的催化剂(主要成分V2O5、V2O4)。利用废催化剂回收制备V2O5的工艺流程如下:
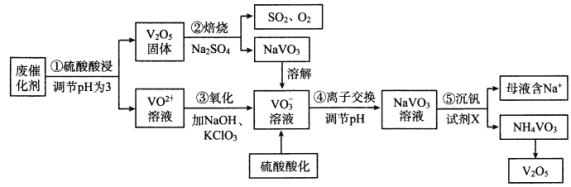
已知:20℃时,NH4VO3的Ksp=1.68×10-2
回答下列问题:
(1)步骤①为提高浸取效率采取的方法有___________(任写两条)
(2)步骤②中反应的氧化剂是___________。
(3)步骤③中ClO3-被还原为Cl-,该反应的离子方程式为__________。
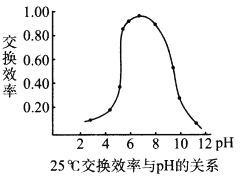
(4)步骤④中,离子交换效率与pH的关系如右图,为提高交换效率应控制的pH范围是___________。
(5)步骤⑤所发生反应的离子方程式为___________。若母液中NH4+的浓度为1.0mol/L,则c(VO3-)=___________。
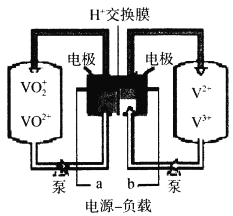
(6)全钒电池是以溶解在一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为电极反应的活性物质。一种全钒电池原理如下图,放电时H+从右向左移动。写出充电时阳极的电极反应式___________,当转移0.1mol电子时,转移H+的物质的量为___________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种测定O2含量的气体传感器如图所示。传感器工作时, 仅Ag+能在α-AgI晶体里迁移,O2透过聚四氟乙烯进入传感器、AgI的物质的量增加。下列有关说法不正确的是
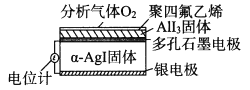
A. 正极反应为I2+2Ag++2e-=2AgI B. 负极反应为Ag+I――e-=AgI
C. 电位计读数越大O2含量越高 D. 部分AlI3固体变为Al2O3固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理研究氮、硫等单质及其化合物的反应有重要意义。
(1)硫酸生产过程中2SO2(g)+O2(g)![]() 2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:
2SO3(g),平衡混合体系中SO3的百分含量和温度的关如图所示,根据如图回答下列问题:

①2SO2(g)+O2(g)![]() 2SO3(g)为__________反应(填“吸热”“放热”)。
2SO3(g)为__________反应(填“吸热”“放热”)。
②一定条件下,将SO2与O2以体积比为2︰1置于一体积不变的密闭容器中发生反应,能说明该反应已达到平衡的是________(填选项字母)。
a.体系的密度不发生变化
b.SO2与SO3的体积比保持不变
c.体系中硫元素的质量分数不再变化
d.单位时间内转移4 mol电子,同时消耗2 mol SO3
e.容器内的气体分子总数不再变化
③V2O5可作为2SO2(g)+O2(g)![]() 2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
2SO3(g)的催化剂,催化循环机理可能为:V2O5氧化SO2时,自身被还原为四价钒氧化物;四价钒氧化物再被氧气氧化为V2O5。写也该催化循环机理的化学方程式__________,________。
(2)一定条件下,合成氨反应为:N2(g)+3H2(g)![]() 2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。
2NH3(g)ΔH<0。图1表示在2 L的密闭容器中反应时N2的物质的量随时间的变化曲线。图2表示在其他条件不变的情况下,改变起始物氢气的物质的量对此反应平衡的影响。

①由图1信息,从11 min起其他条件不变,压缩容器的体积为1 L,则n(N2)的变化曲线为________(填“a”“b”“c”或“d”,下同);增加氮气的物质的量,则n(N2)的变化曲线为________。
②由图2信息,a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是________点,T2____T1(填“>”“=”或“<”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com