
【题目】钒是一种重要的金属材料,其用途之一是制备催化剂,如接触法生产硫酸中使用的催化剂(主要成分V2O5、V2O4)。利用废催化剂回收制备V2O5的工艺流程如下:
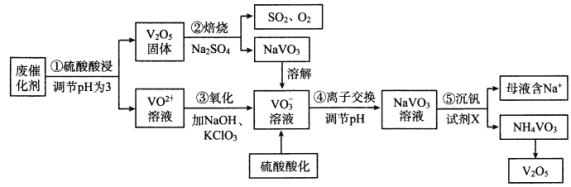
已知:20℃时,NH4VO3的Ksp=1.68×10-2
回答下列问题:
(1)步骤①为提高浸取效率采取的方法有___________(任写两条)
(2)步骤②中反应的氧化剂是___________。
(3)步骤③中ClO3-被还原为Cl-,该反应的离子方程式为__________。
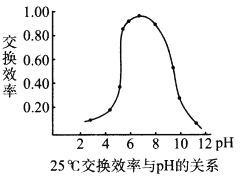
(4)步骤④中,离子交换效率与pH的关系如右图,为提高交换效率应控制的pH范围是___________。
(5)步骤⑤所发生反应的离子方程式为___________。若母液中NH4+的浓度为1.0mol/L,则c(VO3-)=___________。
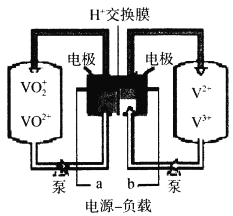
(6)全钒电池是以溶解在一定浓度硫酸溶液中的不同价态的钒离子(V2+、V3+、VO2+、VO2+)为电极反应的活性物质。一种全钒电池原理如下图,放电时H+从右向左移动。写出充电时阳极的电极反应式___________,当转移0.1mol电子时,转移H+的物质的量为___________mol。
【答案】粉碎废催化剂、升高浸取温度或搅拌等 Na2SO4 6VO2++ClO3-+180H-=6VO3-+Cl-+9H2O 6![]() 8 NH4++VO3-=NH4VO3↓ 1.68
8 NH4++VO3-=NH4VO3↓ 1.68![]() 10-2mol/L VO2++H2O-e-=VO2++2H+ 0.1
10-2mol/L VO2++H2O-e-=VO2++2H+ 0.1
【解析】
(1)提高浸取的速率可以提高浸取的效率,因此,可采用增大接触面积(粉碎废催化剂)、升高浸取温度或搅拌等手段。答案:粉碎废催化剂、升高浸取温度或搅拌等。
(2)步骤②中的反应方程式为:2V2O5+2Na2SO4=4NaVO3+2SO2↑+O2↑,根据化合价变化判断只有S![]() ,化合价降低,发生了还原反应,O:-2
,化合价降低,发生了还原反应,O:-2![]() 0化合价升高了,发生了氧化反应,所以氧化剂为Na2SO4;答案:Na2SO4。
0化合价升高了,发生了氧化反应,所以氧化剂为Na2SO4;答案:Na2SO4。
(3)分析参与氧化还原反应的离子,根据电子转移守恒配平,考虑反应条件为碱性环境,反应前加OH-,反应后生成水。即为:6VO2+十ClO3-十180H-=6VO3-+Cl-+9H20。
(4)从图中可知pH为6![]() 8时交换效率最高。答案:6
8时交换效率最高。答案:6![]() 8。
8。
(5)由框图知,由NaVO3经沉钒得生成物NH4VO3知,此反应的离子反应方程式:NH4++ VO3- =NH4VO3↓,已知:20℃时,NH4VO3的Ksp=1.68×10-2,NH4+的浓度为1.0mol/L,代入溶度积常数的表达式c(NH4+)![]() c(VO3-)=1.68×10-2,所以c(VO3-)=1.68×10-2mol/L。答案:1.68×10-2 mol/L。
c(VO3-)=1.68×10-2,所以c(VO3-)=1.68×10-2mol/L。答案:1.68×10-2 mol/L。
(6)放电时H+从右向左移动,则充电时H+从左向右移动,表明电解池(充电时)的阳极为左泵、阴极为右泵,所以阳极反应为VO2++H2O-e-=VO2++2H+。答案:VO2++H2O-e-=VO2++2H+。
当外电路转移0.1mol电子时,根据电量守恒可知溶液中必转移0.1molH+。在阳极有0.1molVOSO4变为了0.05mol(VO2)2SO4+0.05molSO42-,产生的0.2molH+将有0.1mol匹配SO42-,0.1mol移向右泵(阴极)。答案:0.1


 小学能力测试卷系列答案
小学能力测试卷系列答案科目:高中化学 来源: 题型:
【题目】网络趣味图片“一脸辛酸”,是在人脸上重复画满了辛酸的键线式结构(如图)。在辛酸的同分异构体中, 含有一个“-COOH”和三个“-CH3”的结构(不考虑立体异构),除![]() 外,还有( )
外,还有( )
A. 7种 B. 11种 C. 14种 D. 17种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】目前,从海水中提取的溴占世界溴年产量的1/3左右,常用的方法之一是用氧化剂把Br-氧化成单质溴,再通入热空气把溴蒸气吹出,这一反应中常使用的氧化剂是( )
A. O2B. Cl2C. 浓硫酸D. 浓硝酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛋白质是构成生物体内的基本物质,蛋白质的组成元素主要有氢、碳、氮、氧、硫,同时还有微量元素铁、锌等。回答下列问题:
(1)碳、氮、氧三元素的第一电离能由小到大的顺序为________________(用元素符号表示);
(2)N3-的立体构型是___________形:与N3-互为等电子体的一种分子是___________(填分子式)。
(3)将足量的氨水逐滴地加入到ZnSO4溶液中,先生成沉淀,然后沉淀溶解生成配合物[Cu(NH3)4SO4,配位化合物中的阳离子结构式为___________;SO42-中的硫原子杂化方式为___________;用价层电子对互斥理论解释SO42-的键角大于SO32-的原因是_________________________________。
(4)碲化锌晶体有两种结构,其中一种晶胞结构如下图,晶胞中与Zn原子距离最近的Te原子围成____体图形;与Te原子距离最近的Te原子有___个;若Zn与距离最近的Te原子间距为apm,则晶体密度为____g/cm3。
(已知相对原子质量:Zn-65、Te-128)
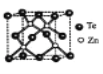
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
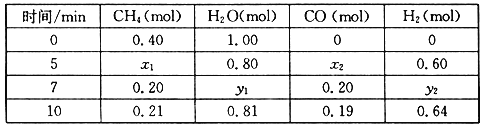
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图为元素在生物体内的含量分布情况,下列表述错误的是
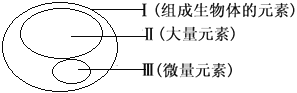
A. P、S、K、Ca、Zn属于大量元素
B. 在非生物界中都能找到,体现生物界与非生物界的统一性
C. Ⅱ和Ⅲ为生物体的必需元素,一旦缺乏就可能会导致相应的病症
D. Ⅲ含量虽少,却是生物体正常生命活动不可缺少的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用某些有机物之间的相互转化可以储存太阳能,如原降冰片二烯(NBD)经过太阳光照转化成为四环烷(Q)。已知: ①C7H8(l)(NBD)+9O2(g)=7CO2(g)+4H2O(l) ΔH1,②C7H8(l)(Q)+9O2(g)=7CO2(g)+4H2O(l) ΔH2,③
![]()
![]() ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
ΔH=+88.62 kJ·mol-1。下列叙述不正确的是( )
A. ΔH1>ΔH2 B. NBD的能量比Q的能量高
C. NBD比Q稳定 D. NBD转化为Q是吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以氧化铝为原料,通过碳热还原法可合成氮化铝(AlN);通过电解法可制取铝。电解铝时阳极产生的CO2,可通过二氧化碳甲醇化再利用。请回答:
(1)已知:2Al2O3(s)=4Al(g)+3O2(g)△H1=+3 351kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣221kJmol﹣1
2Al(g)+N2(g)=2AlN(s)△H3=﹣318kJmol﹣1
则碳热还原Al2O3合成氮化铝的总热化学方程式为_____。
(2)在常压,Ru/TiO2催化下,CO2和H2混合气体(体积比1:4,总物质的量a mol)进行反应,测得CO2的转化率、CH4和CO的选择性随温度的变化情况分别如图1和图2所示(选择性:转化的CO2中生成CH4和CO的百分比)。
反应Ⅰ:CO2(g)+4H2(g)CH4(g)+2H2O(g)△H1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g)△H2
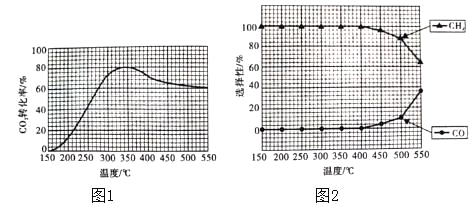
①下列说法不正确的是_____(填序号)。
A.△H1小于零
B.温度可影响产物的选择性
C.CO2的平衡转化率随温度升高先增大后减少
D.其他条件不变将CO2和H2的初始体积比改变为1:3,可提高CO2的平衡转化率
②350℃时,反应Ⅰ在t1时刻达到平衡,平衡时容器的体积为VL.则该温度下反应Ⅰ的平衡常数为____(用a、V表示)。
③350℃时,CH4的物质的量随时间的变化曲线如图所示。画出400℃时,0~t1时间段内,CH4的物质的量随时间的变化曲线。____

(3)CO2和H2在一定条件下发生反应:CO2(g)+3H2(g)CH3OH(g)+H2O(g),平衡常数K=![]() .在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
.在容积为2L的密闭容器中,充入2 mol CO2和6 mol H2,恒温恒容时达到平衡。相同条件下,在另一个2 L的密闭容器中充入a mol CO2、b mol H2、c mol CH3OH、d mol H2O(g),要使两容器达到相同的平衡状态,且起始时反应逆向进行,则d的取值范围为_____。
(4)研究表明,CO2可以在硫酸溶液中用情性电极电解生成甲醇,则生成甲醇的电极反应式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com