
����Ŀ���ϳɰ��Ի�ѧ��ҵ������ҵ������Ҫ���塣
��1����ϳ����а����ʵ���֮��l:4����N2��H2���а��ĺϳɣ�ͼAΪT��ʱƽ�������а��������������ѹǿ(p)�Ĺ�ϵͼ��

��ͼA�а������������Ϊ15��ʱ��H2��ת����Ϊ_______��
��ͼB��T=500�������¶�Ϊ450��ʱ��Ӧ��������_______(����a������b��)��
��2���ϳɰ�������������ɼ�����ˮ��Ӧ�Ƶã���Ӧ���Ȼ�ѧ����ʽΪ��CH4(g)+H2O(g)![]() CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
CO(g)+3H2(g) ��H>0��һ���¶��£������Ϊ2 L�ĺ��������з���������Ӧ�������ʵ����ʵ����仯���±���
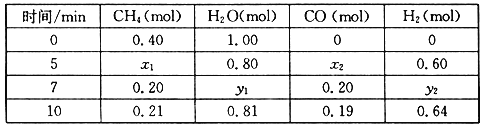
�ٷ����������ݣ��ж�5 minʱ��Ӧ�Ƿ���ƽ��״̬��_____����������������������
�ڸ��¶��£�������Ӧ��ƽ�ⳣ��K=_____________________��
�۷�Ӧ��7~10 min�ڣ�CO�����ʵ������ٵ�ԭ�������____________������ĸ����
a������CH4�����ʵ��� b�������¶� c�������¶� d������H2
�����з����п���֤��������Ӧ�Ѵ�ƽ��״̬����___________��
a����λʱ��������3n mol H2��ͬʱ����n mol CO
b��������ѹǿ���ٱ仯
c����������ܶȲ��ٱ仯
d����������ƽ����Է����������ٱ仯
e��CH4�������������ٱ仯
����֪̼��������Ӧ�ڲ�ͬ�¶���ƽ�ⳣ���Ķ���ֵ��lgK�����±���
������Ӧʽ | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
��ӦCO(g)+H2O(g)![]() CO2(g)+H2(g)��900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_______��
CO2(g)+H2(g)��900Kʱ���÷�Ӧƽ�ⳣ���Ķ���ֵ��lgK��=_______��
��3�����ݻ��ɱ���ܱ������з�����Ӧ��mA(g)+nB(g)![]() pC(g)����һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�:
pC(g)����һ���¶ȺͲ�ͬѹǿ�´ﵽƽ��ʱ���ֱ�õ�A�����ʵ���Ũ�����±�:
ѹǿp/Pa | 2��105 | 5��105 | 1��106 |
c��A��/molL-1 | 0.08 | 0.20 | 0.44 |
�ٵ�ѹǿ��2��105Pa���ӵ�5��105Paʱ��ƽ��______�ƶ�������������������
�ڵ�ѹǿΪ1��106Paʱ���˷�Ӧ��ƽ�ⳣ������ʽΪ______________��
���𰸡� 24.5% b �� 0.0675 d bde 0.36 �� ![]()
��������(1)����N2��ת����Ϊx��
N2 +3H2 ![]() 2NH3
2NH3
��ʼ��140
�仯��x3x��2x
ƽ�⣺1-x4-3x 2x
�������������Ϊ15.00%ʱ����![]() ��100%=15%�����x=0.33������������ת����=
��100%=15%�����x=0.33������������ת����=![]() ��100%��24.5%��
��100%��24.5%��
�ڶ��ڷ�Ӧ N2+3H2![]() 2NH3����H��0�����¶Ƚ���ʱ����ѧƽ������ȷ�Ӧ�����ƶ���������Ӧ�ƶ����������������������Ӧ��������b��
2NH3����H��0�����¶Ƚ���ʱ����ѧƽ������ȷ�Ӧ�����ƶ���������Ӧ�ƶ����������������������Ӧ��������b��
(2)��5minʱH2O�ı仯���ʵ���Ϊ1.00mol-0.8mol=0.2mol����ʱ���ɵ�CO�����ʵ�����Ϊ0.2mol����7minʱCO�����ʵ�����ȣ������CO��H2�����ʵ����ı仯��������жϣ�57min֮�䷴Ӧ�Ǵ���ƽ��״̬������5minʱ��Ӧ�Ǵ���ƽ��״̬��
�ڸ��¶��£�
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
��ʼŨ��Ϊ(mol/L) 0.2 0.5 0 0
�仯Ũ��Ϊ(mol/L) 0.1 0.1 0.1 0.3
��ʼŨ��Ϊ(mol/L) 0.1 0.4 0.10 0.3
���¶��·�Ӧ��ƽ�ⳣ��K=![]() =
=![]() =0.0675��
=0.0675��
�۷�Ӧ��7��10min֮�䣬CO�����ʵ������٣�������������ƽ�������ƶ�������һ����̼��Ũ�ȣ��ʴ�Ϊd��
��a���淴Ӧ�Ľ��У���λʱ��������3n mol H2��ͬʱ����n mol CO����Ϊ����Ӧ���ʣ���a����b����Ӧǰ�������ܵ����ʵ����淴Ӧ�Ľ��У��ڲ��ϱ仯����ƽ��ʱ�������ʵ������䣬��ʱ������ѹǿ���ٱ仯����Ϊƽ��״̬����b��ȷ��c�������������������������ʼ�ղ��䣬���ܶ�ʼ�ղ��䣬���ж��Ƿ�Ϊƽ��״̬����c����d����������������ʼ�ղ��䣬�����������ʵ����Dz���ֵ����������ƽ����Է����������ٱ仯ʱ����ʱ��ӦΪƽ��״̬����d��ȷ��e��CH4�������������ٱ仯��˵����Ӧ������Ծ�ֹ״̬��Ϊƽ��״̬����e��ȷ����Ϊbde��
����֪������C(s)+H2O(g)=CO(g)+H2(g)����ƽ�ⳣ��ΪK1��
����C(s)+2H2O(g)=CO2(g)+2H2(g)����ƽ�ⳣ��ΪK2��
���-��ɵã�CO(g)+H2O(g)CO2(g)+H2(g)���ʸ÷�Ӧƽ�ⳣ��K=![]() ����lgK=lgK2-lgK1=-0.03-(-0.39)=0.36��
����lgK=lgK2-lgK1=-0.03-(-0.39)=0.36��
(3)���ɱ������ݿ�֪��ѹǿ��2��105Pa����Ϊ5��105Paʱ��ѹǿ����2.5���������Ϊ![]() ����Ũ����0.08����Ϊ0.20molL-1��Ҳ����2.5������������ѹǿƽ�ⲻ�ƶ���
����Ũ����0.08����Ϊ0.20molL-1��Ҳ����2.5������������ѹǿƽ�ⲻ�ƶ���
���ɱ������ݿ�֪��ѹǿ��5��105Pa����Ϊ1��106Paʱ��ѹǿ����2���������Ϊ![]() ����Ũ��Ӧ����0.20����Ϊ0.40molL-1������ʵ����A��Ũ��Ϊ0.44��˵��ƽ�����ƣ���Ӧǰ��������ʵ���С�ڷ�Ӧ����������ʵ�������Ӧ��B��������̬�����Դ˷�Ӧ��ƽ�ⳣ������ʽΪK=
����Ũ��Ӧ����0.20����Ϊ0.40molL-1������ʵ����A��Ũ��Ϊ0.44��˵��ƽ�����ƣ���Ӧǰ��������ʵ���С�ڷ�Ӧ����������ʵ�������Ӧ��B��������̬�����Դ˷�Ӧ��ƽ�ⳣ������ʽΪK=![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��W��X��Y��Z��Ϊ������Ԫ�أ�W������������������������֮��Ϊ7��17��X��Wͬ���壻Y��ԭ��������W��X��ԭ������֮�͵�һ�룻��ZԪ�ص�������ɫ��ӦΪ��ɫ�������ж���ȷ���ǣ� ��
A.�����ԣ�Y��Z
B.�⻯��ķе㣺X��W
C.���ӵĻ�ԭ�ԣ�X��W
D.ԭ�Ӽ����Ӱ뾶��Z��Y��X
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ȫȼ��ʱ,��������������
A. CH4 B. C2H6 C. C3H6 D. C6H6
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������Ŵ���Ϣ��������
A. DNA B. DNA��RNA C. RNA D. DNA��RNA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Na2CO3��NaHCO3��˵���У�����ȷ���ǣ� ��
A. ��������ˮ B. ��Ϊ��ɫ����
C. ���Ⱦ��ֽ� D. ���������ᷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й�����ڿ�ѧ����û�д�������( )
A. XX�ư˱����ɹ�Բ���춹��Ŵ�Ⱦ��ƶ��ɣ������ǣ��ʺ�������ʳ��
B. ���������XXϵ�����ϣ������Ͼ��Բ����κλ�ѧ����
C. ��������ͣ�����ά����D�����������ı��������������ٽ���������
D. ���ֿڷ�Һ���зḻ��N��P��Zn����Ԫ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪���ӷ�����������������NaBr��KI�Ļ����Һ��ͨ�������������ַ�Ӧ����Һ���ɣ��������������ʣ����ʣ��Ĺ�����
A. NaCl��KI B. NaCl��KCl C. KCl��NaBr D. KCl��NaCl��I2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ�����ﳣ��Ũ������������̷�Ӧ����ȡ��������������ȡһ������Ũ����ʹ����������̷�����Ӧ�������������ڱ�״���µ����Ϊ22.4L��
��ش��������⣺
��1��д���÷�Ӧ�����ӷ�Ӧ����ʽ ��
��2���μӷ�Ӧ�Ķ������̵�����Ϊ ��
��3����Ӧ�б�������HCl�����ʵ���Ϊ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����19.2g ��Cu����������ϡ�����У�����Cu��ȫ��Ӧ����֪��
3Cu+8HNO3��ϡ��=3Cu��NO3��2+2NO��+4H2O��
��1�����ɵ�NO�ڱ�״���µ������
��2������ԭ�������������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com