
【题目】把19.2g 的Cu放入足量的稀硝酸中,微热至Cu完全反应.已知:
3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O求:
(1)生成的NO在标准状况下的体积.
(2)被还原的硝酸的质量.
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
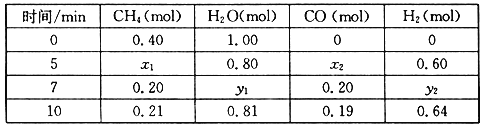
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中,被氧化与被还原的元素是同一元素的是( )
A.Cl2+2NaOH═NaCl+NaClO+H2O
B.Fe+CuSO4═FeSO4+Cu
C.2KClO3 ![]() 2KCl+3O2↑
2KCl+3O2↑
D.3NO2+H2O=2HNO3+NO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(ρ=1.84g/cm3)配制1mol/L稀硫酸100mL.
(1)实验中应选用的仪器是(填字母).
A.1000mL量筒 B.托盘天平
C.玻璃棒 D.50mL容量瓶
E.10mL量筒 F.50mL烧杯
G.100mL容量瓶 H.胶头滴管
(2)实验操作:
a.用100mL量筒量取98%的浓硫酸mL;
b.选取对应规格的容量瓶,洗涤,检查是否漏液,将稀释并冷却至室温的硫酸溶液沿玻璃棒转移到此容量瓶中;
c.用少量蒸馏水洗涤小烧杯和玻璃棒23次,并将洗涤液转移到容量瓶中;
d.在小烧杯内稀释浓硫酸,稀释时要用玻璃棒不断搅拌;
e.向容量瓶中直接加蒸馏水至离刻度线12cm处;
f.盖上容量瓶瓶塞,摇匀;
g.用胶头滴管小心加蒸馏水至刻度线;
h.将配制好的溶液转移入含少量蒸馏水的试剂瓶中贮存备用.
(3)实验分析:
①正确的操作步骤是(填序号).
②此实验中玻璃棒的作用是 .
③实验操作中有两处错误,这两处错误是:
I. .
II. .
④下列操作对所配溶液的浓度有何影响?(填“偏高”“偏低”或“无影响”)
Ⅰ. 转移硫酸后,小烧杯未洗涤 .
Ⅱ.量取浓硫酸的量筒用蒸馏水洗涤两次,并将洗涤液转入容量瓶中 .
Ⅲ.定容时俯视容量瓶刻度线 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图中烧杯中盛的是天然水,铁腐蚀的速率由快到慢的顺序是( )

A. ③>②>①>⑤>④ B. ⑤>②>①>③>④ C. ⑤>②>③>④>① D. ③>④>⑤>②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法不正确的是( )

A.正极反应中有CO2生成
B.微生物促进了反应中电子的转移
C.质子通过交换膜从正极区移向负极区
D.电池总反应为C6H12O6+6O2=6CO2+6H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关系中正确的是( )
A. 将AgCl、AgBr饱和溶液等体积混合后,滴加足量的硝酸银溶液,其主要沉淀物为AgBr
B. 常温下,浓度为0.1molL﹣1的HA溶液(Ka=10﹣5)pH≈3
C. c(SO32﹣)相等的Na2SO3溶液、NaHSO3溶液、H2SO3溶液的浓度:c(NaHSO3)>c(H2SO3)>c(Na2SO3)
D. 25℃时,向10mL0.01molL﹣1KOH溶液中滴加10mL0.01molL﹣1的醋酸溶液后,混合液中:c(K+)>c(CH3COO﹣)>c(OH﹣)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E、F是原子序数依次增大的前四周期元素,A与C同主族,A与B、A与E形成共价化合物,A与B形成的最简单化合物的水溶液呈碱性,E的最高正化合价与最低负化合价的代数和为4,D是同周期中简单离子半径最小的元素,F元素对应的单质为日常生活中常见金属.
(1)F在元素周期表中的位置时_____.
(2)B、D、E的简单离子半径由大到小的顺序为_____(离子符号表示).
(3)B的气态氢化物与其最高价氧化物对应的水化物反应生成的化合物中存在的化学键类型为_____,写出检验该化合物中阳离子的离子方程式_____.
(4)写出由A、B元素形成的六核分子的电子式_____.
(5)已知常温下化合物FE的Ksp=6×10﹣18mol2L﹣2,常温下将1.0×10﹣5molL﹣1的Na2E溶液与含FSO4溶液按体积比3:2混合,若有沉淀FE生成,则所需的FSO4的浓度至少是_____.(忽略混合后溶液的体积变化).
图中均含D或F元素的物质均会有图示转化关系:
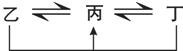
①均含D元素的乙、丙、丁微粒间的转化全为非氧化还原反应;
②均含F元素的乙(单质)、丙、丁微粒间的转化全为氧化还原反应.
请回答下列问题:
a.均含有D元素的乙与丁在溶液中发生反应的离子方程式_____.
b.丙、丁分别是含F元素的简单阳离子,检验含丙、丁两种离子的混合溶液中的低价离子,可以用酸性KMnO4溶液,其对应的离子方程式为:_____.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com