
【题目】下列说法不正确的是( )
A. 用饱和食盐水替代水跟电石作用,可以有效控制产生乙炔的速率
B. 食品包装材料聚乙烯因发生加成反应而易老化
C. ![]() 的名称为4—苯基—2—丁醇
的名称为4—苯基—2—丁醇
D. 重结晶法提纯苯甲酸时,为除去杂质和防止苯甲酸析出,应该趁热过滤
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.下列 A、B、C、D 是中学常见的混合物分离或提纯的基本装置。
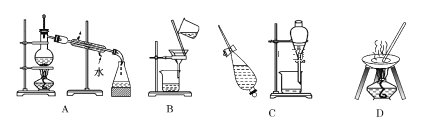
请根据混合物分离或提纯的原理,回答在下列实验中需要使用哪种装置。将 A、B、C、D 填入适当的空格中。
(1)从碘水中提取碘____________________;
(2)分离酒精与水的混合物____________________;
(3)除去粗盐中的泥沙制精盐________________。
Ⅱ.实验室配制一定物质的量浓度溶液要用到量筒和图Ⅱ仪器等。配制某浓度的稀硫酸,用 10 mL 量筒量取浓硫酸的体积如图Ⅰ所示,
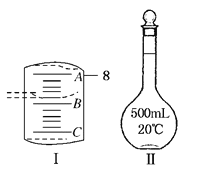
(1)A 与 B,B 与 C 刻度间相差 1mL,如果刻度 A 为8,量筒中浓硫酸的体积是________mL。
(2)要用 CuSO4·5H2O 晶体配制 480mL 0.1mol/L CuSO4 溶液,应该用托盘天平称取CuSO4·5H2O____
(3)图Ⅱ所示仪器的名称是_________仪器有下列情况,对配制溶液的浓度有何影响?(填“偏高”、 “偏低”或“无影响”)
A.仪器中有少量蒸馏水______________;
B.定容时加水超过刻度线______________;
C.最终定容时俯视观察液面____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 把100 mL 3 mol·L-1的H2SO4跟100 mL H2O混合,硫酸的物质的量浓度改变为1.5 mol·L-1
B. 把200 mL 3 mol·L-1的BaCl2溶液跟100 mL 3 mol·L-1的KCl溶液混合后,溶液中的c(Cl-)仍然是3 mol·L-1
C. 把100 g 20%的NaCl溶液跟100 g H2O混合后,NaCl溶液的质量分数是10%
D. 把100 mL 20%的NaOH溶液跟100 mL H2O混合后,NaOH溶液的质量分数是10%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是( )
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向20 mL 0.100 0 mol·L-1 H2C2O4溶液中滴加0.100 0 mol·L-1 NaOH溶液,混合溶液的pH随滴加NaOH溶液体积的变化关系如图所示。下列有关叙述错误的是
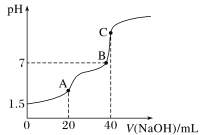
A. 忽略H2C2O4的第二步电离,由题给信息,可以计算出常温下H2C2O4的电离常数
B. A、B、C三点所对应的溶液中,水的电离程度最小的是A点
C. A、B、C三点所对应的溶液中,均有c(Na+)<c(OH-)+c(HC2O4-)+2c(C2O42-)
D. 在B点溶液中,生成的含钠化合物有两种,且c(HC2O4-)+2c(C2O42-)=0.100 0 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有人设计以苯为原料合成一种新型涂料固化剂F的路线如下:
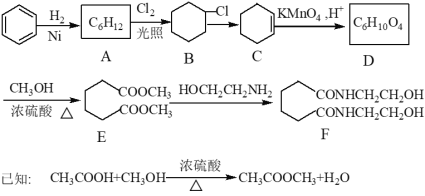
(1)A的结构简式为_____________________________。
(2)D的官能团名称为__________________。在D的同分异构体中,与D含有相同种类和数目的官能团,且核磁共振氢谱的峰面积之比为3:1:1 的有机物的结构简式为_________。
(3)反应B→C的化学方程式为(注明反应条件)_____________。
(4)写出反应类型: ① B→C: _____________; ② C→D:________; ③ E→F:____________
(5)上述合成路线主要缺陷是步骤A→B的反应, 该步骤存在缺陷的原因是_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积一定的密闭容器中,置入一定量的NO(g)和足量C(s),发生反应C(s)+2NO(g) ![]() CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )
CO2(g)+N2(g),平衡状态时NO(g)的物质的量浓度[NO]与温度T的关系如图所示。则下列说法中正确的是( )

A. 该反应的ΔH>0
B. 若该反应在T1、T2时的平衡常数分别为K1、K2,则K1<K2
C. 在T2时,若反应体系处于状态D,则此时一定有v正<v逆
D. 在T3时,若混合气体的密度不再变化,则可以判断反应达到平衡状态C
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙酸乙酯能在多种条件下发生水解反应:CH3COOC2H5+H2OCH3COOH+C2H5OH.已知该反应的速率随c(H+)的增大而加快。如图为CH3COOC2H5的水解速率随时间的变化图。下列说法正确的是( )
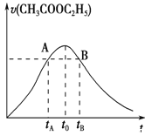
A. 反应初期水解速率增大可能是溶液中c(H+)逐渐增大所致
B. A、B两点表示的c(CH3COOC2H5)相等
C. 图中t0时反应达到平衡状态
D. tB时CH3COOC2H5的转化率低于tA时CH3COOC2H5的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧化还原反应原理在生产生活和科学研究中应用广泛。
(1)下列表述中没有氧化还原反应发生的是_____。
a.滴水成冰 b.蜡炬成灰 c.百炼成钢
(2)NH3和Cl2反应的方程式为:NH3+Cl2﹣N2+HCl
①该反应中被氧化的元素是_____(填元素名称),氧化剂是_____(填化学式)。
②配平该方程式:_____NH3+_____Cl2=_____N2+_____HCl
(3)“地康法”制氯气的反应原理图示如下:
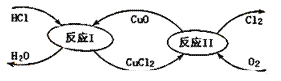
①反应I的化学方程式为_____。
②若要制得标准状况下氯气11.2L,则整个反应中转移电子的物质的量为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com