
【题目】现有短周期主族元素R、X、Y、Z。若它们的最外层电子数用n表示,则有:n(X)+n(Y)=n(Z),n(X)+n(Z)=n(R)。这四种元素组成一种化合物Q,Q具有下列性质:
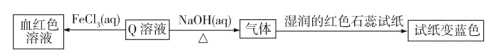
下列说法错误的是
A.原子半径:Y>Z>XB.最高价氧化物对应水化物酸性:Y<Z
C.X和Y组成的化合物在常温下都呈气态D.Y3Z4是共价化合物
【答案】C
【解析】
根据题给信息,Q溶液与FeCl3溶液反应生成血红色物质,可知Q溶液中含有SCN-;Q溶液与NaOH溶液共热会生成一种使湿润的红色石蕊试纸变蓝的气体,可知该气体为NH3,则Q溶液中含有NH4+。由此可推断出Q为NH4SCN。根据最外层电子数关系可知X为氢元素,Y为碳元素,Z为氮元素,R为硫元素。
A.同一周期从左至右,原子半径逐渐减小,故原子半径:C>N,H原子只有一个电子层,原子半径最小,故三者原子半径大小关系为:C>N>H,A项正确;
B.同一周期从左向右,最高价氧化物对应水化物的酸碱性规律为:碱性逐渐减弱,酸性逐渐增强。故HNO3的酸性比H2CO3强,B项正确;
C.C、H组成的烃类化合物中,常温下苯等烃类呈液态,C项错误;
D.C3N4类似于Si3N4,同属于原子晶体,是共价化合物,D项正确;
答案选C。


科目:高中化学 来源: 题型:
【题目】如图所示标出的是元素周期表的一部分元素,据图回答下列问题。
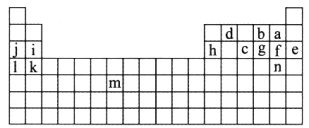
(1)图中用字母标出的14种元素中,化学性质最不活泼的是________(用元素符号表示,下同),金属性最强的是________,非金属性最强的是________,常温下单质为液态的非金属元素是________________,属于过渡元素的是________(本空用图中字母表示)。
(2)b、f、c气态氢化物的化学式分别为________、________、________,其中热稳定性最弱的是______。
(3)图中第三周期元素中原子半径最小的是________(稀有气体元素除外)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研人员提出HCHO与O2在羟基磷灰石(HAP)表面催化氧化生成CO2、H2O的历程,该历程示意图如图(图中只画出了HAP的部分结构)。下列说法不正确的是( )
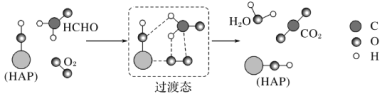
A.HAP能提高HCHO与O2的反应速率
B.HCHO在反应过程中,有C—H键发生断裂
C.根据图示信息,CO2分子中的氧原子全部来自O2
D.该反应可表示为:HCHO+O2![]() CO2+H2O
CO2+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为原料制取高纯H2是重要的研究方向。回答下列问题:
(1)甲醇水蒸气重整制氢主要发生以下两个反应。
主反应:CH3OH(g)+H2O(g)![]() CO2(g)+3H2(g) △H=+49kJ·mol-1
CO2(g)+3H2(g) △H=+49kJ·mol-1
副反应:H2(g)+CO2(g) ![]() CO(g)+H2O(g) △H=+41kJ·mol-1
CO(g)+H2O(g) △H=+41kJ·mol-1
①甲醇在催化剂作用下裂解可得到H2和CO,反应的热化学方程式为__________________,既能加快反应速率又能提高CH3OH平衡转化率的一种措施是_________________________。
②适当增大水醇比[n(H2O):n(CH3OH)],有利于甲醇水蒸气重整制氢,理由是___________。
③某温度下,将n(H2O):n(CH3OH)=1:1的原料气充入恒容密闭容器中,初始压强为p1,反应达到平衡时总压强为p2,则平衡时甲醇的转化率为_________________(忽略副反应)。
(2)工业上常用CH4与水蒸气在一定条件下来制取H2,其反应原理为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
CO(g)+3H2(g) △H=+203kJ·mol-1,在容积为3L的密闭容器中通入物质的量均为3mol的CH4和水蒸气,在一定条件下发生上述反应,测得平衡时H2的体积分数与温度及压强的关系如图所示。
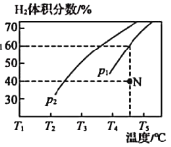
压强为p1时,在N点:v正_______v逆(填“大于”“小于”或“等于”),N点对应温度下该反应的平衡常数K=________mol2·L-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液。由该废液回收铜并得到净水剂(FeCl36H2O)的步骤如下:
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,通入足量氯气;
IV.……,得到FeCl36H2O晶体。
(1)用FeCl3溶液腐蚀铜箔的离子方程式是_____________;
(2)试剂A是______;
(3)取少量步骤III所得的溶液于试管中,能够证明通入氯气足量的是______;
a. 检验Cl2的存在 b. 检验Fe3+的存在 c. 检验Fe2+的不存在
(4)完成步骤IV需要用到的实验装置是______(填字母)。
a b
b c
c d
d
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组设计了如图甲所示的数字化实验装置,研究常温下,向1L 0.1mol/L H2A溶液中逐滴加入等浓度NaOH溶液时的pH变化情况,并绘制出溶液中含A元素的粒子的 物质的量分数与溶液pH的关系如图乙所示,(已知HA=H++HA- HA- ![]() H++A2-)则下列说法中正确的是( )
H++A2-)则下列说法中正确的是( )

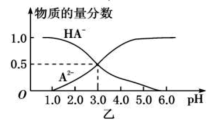
A.pH=3.0时,可以计算出Ka2= 10 -3
B.0.1mol/LNaHA溶液中存在c(A2-)+c(HA-)+c(H2A)=0.1mol/L
C.该实验左边的滴定管为碱式滴定管,用来盛装NaOH溶液,烧杯中并加酚酞作指示剂
D.常温下,将等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液pH=3.0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,反应:![]() 的数据如图所示。下列说法正确的是( )
的数据如图所示。下列说法正确的是( )
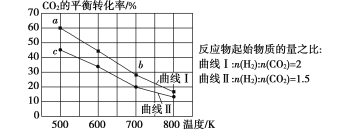
A.该反应的![]()
B.达到平衡时,![]()
C.b点对应的平衡常数K值大于c点
D.a点对应的![]() 的平衡转化率为90%
的平衡转化率为90%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设阿伏加德罗常数的值为NA。有关化工原料苯乙炔![]() 的下列叙述正确的是
的下列叙述正确的是
A.51 g该物质中含有单键数目为2NAB.标准状况下,22.4 L苯乙炔最多消耗2NA个HCl
C.1mol苯乙炔分子中共线的原子数最多为6NAD.苯乙炔与足量H2加成产物的一氯代物有5种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把6.5gZn放入足量的盐酸中,锌完全反应。计算:
(1)6.5gZn的物质的量?_________。
(2)参加反应的HCl的物质的量?_________。
(3)生成氢气的体积(标准状况)?__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com