
����Ŀ������ƽ�����ʢ��ǿ��ԭ��Һ̬�£�N2H4����ǿ������Һ̬˫��ˮ�������ǻ�Ϸ�Ӧʱ������������������ˮ���������ų��������ȡ���֪0.4molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652kJ��������
��1����Ӧ���Ȼ�ѧ����ʽΪ____________________
��2������֪H2O(l)��H2O(g)��H=+44kJ��mol-1����16gҺ̬����Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų���������________kJ
��3���˷�Ӧ���ڻ���ƽ������ͷŴ����ȺͿ��ٲ������������⣬����һ���ܴ���ŵ���_____
���𰸡���6�֣�ÿ��2�֣�
��1��N2H4(l)��2H2O2(l)===N2(g)��4H2O(g)��H����641.63 kJ��mol��1
��2��408.815
��3���Ի�������Ⱦ
��������
��1������0.4molҺ̬����������Һ̬˫��ˮ��Ӧ�����ɵ�����ˮ�������ų�256.652kJ����������֪1mol N2H4��ȫ��Ӧ�ų�����Ϊ256.652kJ��1/0.4��641.63kJ������N2H4��ȫ��Ӧ���Ȼ�ѧ����ʽΪ��N2H4(l) +2H2O2(l)=N2(g)+4H2O(g) ��H=-641.63kJ��mol-1���𰸣�N2H4(l) +2H2O2(l)=N2(g)+4H2O(g) ��H=-641.63kJ��mol-1��
��2����ΪH2O(l)��H2O(g)����H=+44kJ��mol-1��16gҺ̬��Ϊ0.5mol,��Һ̬˫��ˮ��Ӧ����Һ̬ˮʱ�ų�������Ϊ��641.63+44![]() 4��kJ
4��kJ![]() 0.5=408.815 kJ���𰸣�408.815��
0.5=408.815 kJ���𰸣�408.815��
��3����Ϊ�÷�Ӧ������Ϊ������ˮ���������Բ��ﲻ����ɻ�����Ⱦ���𰸣����ﲻ����ɻ�����Ⱦ�ȡ�


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ĺ����ߣ����躣Ͽ��������������ˮ���ۺ����ô��п�Ϊ. ��ˮ���庬��ԼΪ65 mg��L��1���Ӻ�ˮ����ȡ��Ĺ���������ͼ��

(1)���ϲ�������ѻ������̬���壬������ֽ�֮ת��ɻ���̬���壬��Ŀ����______.
(2)�����ͨ���ȿ�����ˮ��������Br2�����������________��
A�������� B����ԭ�� C���ӷ��� D����ʴ��
(3)�������̢����漰�����ӷ�Ӧ���£��������淽���������ʵ��Ļ�ѧ��������
______Br2��______CO32-===______BrO3-��______Br����______CO2��
(4)���������д�������������Ҳ�����ö�������ˮ��Һ���գ�������������������.д�������������ˮ��Һ��Ӧ�Ļ�ѧ����ʽ��_____.
(5)ʵ���ҷ����廹�������ܼ���ȡ�������п������������ȡ������________.
A.�Ҵ� B.���Ȼ�̼ C.�ռ���Һ D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й�ʵ��װ�õ�˵������ȷ����
A.��ͼ1װ����ȡ���﴿����NH3 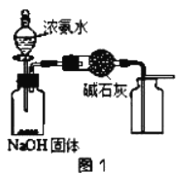
B.��ͼ2װ��ʵ�����Ʊ�Fe(OH)2 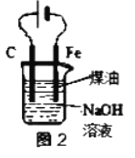
C.��ͼ3װ�ÿ����������Ȫ��ʵ��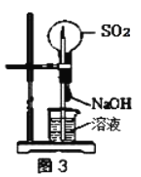
D.��ͼ4װ�ò���Cu��Ũ���ᷴӦ������������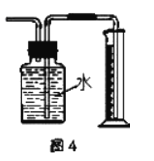
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֿ���������A��B��C��D��E���������������������ӻ�����ͬ���ֱ�������������Al3����Fe3����Cu2����Ba2����K��������������NO![]() ��OH����Cl����CO
��OH����Cl����CO![]() ��Xn-(n=1��2)�е�һ�֡�
��Xn-(n=1��2)�е�һ�֡�
��1��ijͬѧͨ���ȽϷ�������Ϊ�������Ϳ��ж����б��е�����������_____��_____��
��2������C�к�������Xn-��Ϊ��ȷ��Xn-���ֽ�(1)�е��������ʼ�ΪA��B����C��A����Һ���ʱ������ɫ��������ó����е�������ϡHNO3�����������ܽ⣬ʣ���ɫ���壬��XΪ________(����ĸ)��
A��Br�� B��CH3COO�� C��SO![]() D��HCO
D��HCO![]()
��3����38.4 g CuͶ��װ������D��Һ���Թ��У�Cu���ܽ⣬�ٵμ�ϡH2SO4��Cu���ܽ⣬�ܿڸ����к���ɫ������֣�������Dһ���������������е�________(����Ӧ�����ӷ���)��д��Cu�ܽ�����ӷ���ʽ____________________________________________����Ҫ��Cu��ȫ�ܽ⣬���ټ���H2SO4�����ʵ�����_____________��
��4��E��Һ������ᷴӦʱ������ʹ���۱��������ʣ��÷�Ӧ�����ӷ���ʽΪ___________________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ʯ�ͼ۸�IJ������ǣ���úΪԭ���Ʊ�һЩ������Ʒ��ǰ���ֱ����á���ͼ����úΪԭ������������ϩ��PVC����������ë�ĺϳ���·��

��ش��������⣺
��1��д����Ӧ���ͣ���Ӧ��______________����Ӧ��__________________��
��2��д���ṹ��ʽ��PVC________________��C______________________��
��3��д��A![]() D�Ļ�ѧ����ʽ_______________________________��
D�Ļ�ѧ����ʽ_______________________________��
��4����D��Ϊͬ���칹���ҿɷ�������ˮ���������________������������״����������д������һ�ֵĽṹ��ʽ_______________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л��Ļ�ԴԶ������������ӻ�ѧ���ӽǿ����������ⲻ��ȷ���ǣ� ��
A. ��ǧ�����������࣬������ɳʼ���������������������൱�ڷ����ᴿ�����е���������
B. ˾ĸ�춦����ͭ��Ʒ�����ҹ��Ŵ��Ƽ���Գɾ͵Ĵ���֮һ
C. ����(China)�������β�Ʒ��Chinaһ����ָ�����������ⷴӳ���������������й���Ϊ������������������
D. ��°����ҹ���ѧ��ҵ�ĵ���ˣ���Ҫ�ɾ�: �����Ƽ���ü�ָ�����ռ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����KOH��Һ��ͨ��11.2 L����״��������ǡ����ȫ��Ӧ�������ֺ����Σ� 0.7molKCl��0.2molKClO��X����X��
A. 0.1molKClO4 B. 0.1molKClO3
C. 0.2molKClO2 D. 0.1molKClO2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������������������ڴ��������еĵ�����������Ļ�ѧ��ӦΪ��2NH3(g)+NO(g)+NO2(g) ![]() 2N2(g)+ 3H2O(g) ��H<0���ں��ݵ��ܱ������У������й�˵����ȷ���� �� ��
2N2(g)+ 3H2O(g) ��H<0���ں��ݵ��ܱ������У������й�˵����ȷ���� �� ��
A. ƽ��ʱ�������������䣬�����¶ȿ�ʹ�÷�Ӧ��ƽ�ⳣ������
B. ƽ��ʱ�������������䣬����NH3��Ũ�ȣ������е��������ת���ʼ�С
C. ��λʱ��������NO��N2�����ʵ�����Ϊ1��2ʱ����Ӧ�ﵽƽ��
D. �����������䣬ʹ�ø�Ч�����������е��������ת��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���״���һ����Ҫ�Ŀ�������Դ��
(1)���ö�����̼�ϳɼ״���������͡�
��֪��2CH3OH(l) +3O2(g)��4H2O(l)+2CO2(g) ��H����1453.0 kJ��mol��2H2(g) + O2(g)��2H2O(l) ��H����571.6 kJ��mol
����CO2(g)+3H2(g) ��CH3OH(l)+ H2O(l)�ķ�Ӧ�ȡ�H��___________ kJ��mol��
(2)��ͼ�Ƿ�ӦCO(g)+2H2(g)![]() CH3OH(g)��CO��CH3OH(g)�����ʵ���Ũ����ʱ��(t)�ı仯���ߣ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����H2��ʾ�ķ�Ӧ����v(H2)=______________��
CH3OH(g)��CO��CH3OH(g)�����ʵ���Ũ����ʱ��(t)�ı仯���ߣ��ӷ�Ӧ��ʼ���ﵽƽ��ʱ����H2��ʾ�ķ�Ӧ����v(H2)=______________��
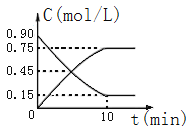
(3)��һ���ݵ��ܱ������г���1mol CO��2mol H2��������ӦCO(g)+2H2(g)![]() CH3OH(g)��H���ﵽƽ�⣬CO��ƽ��ת�������¶�(T)��ѹǿ(P)�ı仯������ͼ��ʾ��
CH3OH(g)��H���ﵽƽ�⣬CO��ƽ��ת�������¶�(T)��ѹǿ(P)�ı仯������ͼ��ʾ��
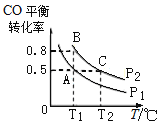
�����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬����_____(��ѡ����ĸ)��
A��H2���������ʵ���CH3OH���������ʵ�2��
B��H2������������ٸı�
C��H2��ת���ʺ�CO��ת�������
D����������ƽ����Է����������ٸı�
�ڱȽ�ƽ�ⳣ��KA��KB��KC�Ĵ�С��____________
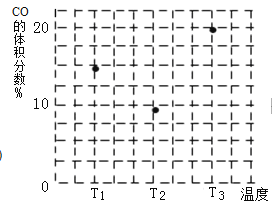
(4)���ݻ���ΪV L�ļס��ҡ��������ܱ������зֱ����amol CO��2a mol H2�����������ķ�Ӧ�¶ȷֱ�ΪT1��T2��T3�Һ㶨���䣬������������ͬ������£�ʵ���÷�Ӧ�����е�t minʱCO�����������ͼ��ʾ����ʱ����������һ�����ڻ�ѧƽ��״̬����________(����T1������T2�� ����T3��)��
(5)�绯ѧ�����ǵ�����������ռ��Խ��Խ��Ҫ�ĵ�λ��
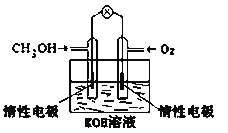
��ȼ�ϵ����һ����ɫ��������Ч�Ļ�ѧ��Դ��ͼΪ�״�ȼ�ϵ�أ�����ӦʽΪ_____________��
���ü״�ȼ�ϵ�ص��300mL����ʳ��ˮ(���Ե缫)����������ӷ���ʽΪ____________________�����һ��ʱ�����Һ��pHֵΪ13ʱ������O2������Ϊ_______g��(������Һ����仯)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com