
| V |
| Vm |
| 0.112L |
| 22.4L/mol |
| 100ag |
| 26g/mol |
| 50a |
| 13 |
| 50a |
| 13 |
| 50a |
| 13 |


科目:高中化学 来源: 题型:
| A | ①能使溴的四氯化碳溶液褪色;②比例模型为: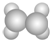 ; ;③能与水在一定条件下反应生成C |
| B | ①由C、H两种元素组成;②球棍模型为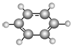 |
| C | ①由C、H、O三种元素组成;②能与Na反应,但不能与NaOH溶液反应; ③能与E反应生成相对分子质量为100的酯 |
| D | ①相对分子质量比C少2;②能由C氧化而成 |
| E | ①由C、H、O三种元素组成;②球棍模型为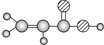 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | X | Y | Z | 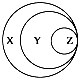 |
| A | 胶体 | 混合物 | 淀粉溶液 | |
| B | 化合物 | 酸性氧化物 | 一氧化氮 | |
| C | 气态氢化物 | 化合物 | 液溴 | |
| D | 强电解质 | 强酸 | 硫酸 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
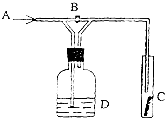 如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )
如图是一种试验某种气体化学性质的实验装置,图中B为开关.如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去.则D瓶盛的溶液是( )| A、浓硫酸 |
| B、饱和食盐水 |
| C、浓氢氧化钠溶液 |
| D、氢氧化钙悬浊液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
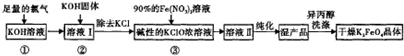
查看答案和解析>>
科目:高中化学 来源: 题型:
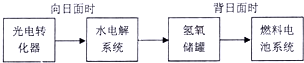
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com