
����Ŀ����̽�ն�Ա�� ���ᣬ��С���߽��˻�ѧ�Թ�����֪�����߳�������Ϊ�Թ������ࡰ���˵�Ұ�ޡ������������ᷴӦ�����ʻ�����ˮ��Һ�����������ܿ����ǣ�������ͨ����
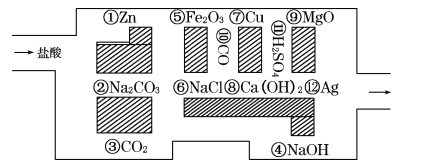
(l)����������߳��Թ�������ͼ������ǰ���������������ʾ���ߵ�·�ߣ��������___ �� ___������ߡ�___ ��
(2)���ܡ��Ե�������Ļ�ѧ��Ӧ�У����ڷ�������ԭ��Ӧ���� ___�����ܡ��Ե���������������������ᷢ����Ӧ�����ӷ���ʽΪ____��
(3)�ڲ��������ᷴӦ�������У����ڵ���ʵ���______��������ǰ����ţ���ͬ�������ڷǵ���ʵ��� ___������״̬�ܵ������____��
���𰸡��� �� 5 CO32��+ 2H+ = CO2��+ H2O �� �ۢ� �ޢ�
��������
�����������������Щ���ʷ�Ӧ���Ӷ��ƶϳ�����ͨ����·����
(1)ͼ�����ʢۡ��ޡ��⡢�ߡ������������ᷴӦ���ظ�·�߿��߳��Թ����ʴ�Ϊ���ۡ��ޡ� ��
(2) ������NaOH��Ca(OH)2�ķ�Ӧ��������кͷ�Ӧ��������Fe2O3��MgO��Na2CO3��Ӧ�Ǹ��ֽⷴӦ���ʷ�������ԭ��Ӧ����5�����ܡ��Ե������������Na2CO3���÷�Ӧ�����ӷ���ʽΪCO32-��2H��=CO2����H2O���ʴ�Ϊ��5��CO32-��2H��=CO2����H2O��
(3) ���������ᷴӦ�������У�NaCl��H2SO4���ڵ���ʣ�CO2��CO���ڷǵ���ʣ�����״̬�ܵ������NaCl��Cu��Ag���ʴ�Ϊ�������ۢ⣬�ޢ���


 ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д�
ӥ�ɽ̸��νӽ̲ĺӱ�����������ϵ�д� ���������ν�ϵ�д�
���������ν�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪aXn+��bYm���ĵ��Ӳ�ṹ��ͬ�������й�ϵʽ��ȷ���ǣ� ��
A.a=b+m+n
B.a=b��m+n
C.a=b+m��n
D.a=b��m��n
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����з����˼ӳɷ�Ӧ���ǣ� ��
A.C2H4ʹ���Ը��������Һ��ɫ
B.C2H4ʹ���CCl4��Һ��ɫ
C.C2H4ȼ�����ɶ�����̼��ˮ
D.CH4��Cl2�Ļ�������ڹ�������������ɫ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������ֵ���øA��B��ijС��Ϊ̽����ͬ�¶������������ֵ���ø�Ļ��ԣ���������̽��ʵ�顣
ʵ����̣�
��� ���� | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
��������ˮԡ���¶�/�� | 20 | 30 | 40 | 50 | 20 | 30 | 40 | 50 |
����ȡ8ֻ�Թܸ����������Һ/mL���ֱ���5 min | 10 | 10 | 10 | 10 | 10 | 10 | 10 | 10 |
������ȡ8ֻ�Թܸ������������ø��Һ���ֱ���5 min | øA | øA | øA | øA | øA | øA | øA | øA |
������ͬ�������Թ��еĵ�����Һ�����ø��Һ���ҡ�ȣ�����5 min | ||||||||
ʵ�������Ը�����ۺ������м�⣬�����ͼ��ʾ��
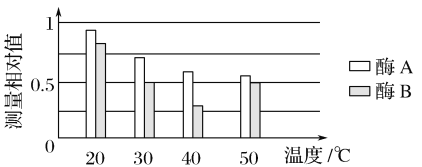
��1����ʵ����Ա�����________���ر�����________������д��2������
��2������ʵ����������øA��________������ʱ���Խϸߡ�
��3����ʵ��ͨ�������۵�ʣ��������ʾø�Ļ��ԣ�����������Լ������������ѿ�ǵĺ�������ʾ��˵�����ɣ�________________��
��4����Ҫ��һ��̽��øB�������¶ȣ�ʵ����Ƶ���Ҫ˼·Ӧ�ǣ���________��֮��������С���¶��ݶȵķ���ʵ�飬�������������ʵ�飬��������ó����ۡ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���ʾʵ�飬����ͽ��۾���ȷ����
ѡ�� | ʵ�� | ���� | ���� |
A | ��Ũ�Ⱦ�Ϊ0.lmol/LNaCl��NaI�����Һ�еμ�����AgNO3��Һ | ���ֻ�ɫ���� | Ksp(AgCl)>Ksp(AgI) |
B | �����£��ⶨ�����ʵ���Ũ�ȵ� Na2CO3��Na2SO3��Һ��pHֵ | ǰ�ߵ�pHֵ�Ⱥ��ߵĴ� | �ǽ����ԣ�S>C |
C | ��ij��Һ�м��������ữ���Ȼ�����Һ | ��Һ���а�ɫ�������� | ����Һ�к���SO42- |
D | ��FeCl3��KSCN�����Һ�У���������KC1���� | ��Һ��ɫ��dz | FeCl3+3KSCN |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����20mL0.5mol L-1�Ĵ�����Һ����μ�������ʵ���Ũ�ȵ��ռ���Һ���ⶨ�����Һ���¶ȱ仯��ͼ��ʾ�����й��ڻ����Һ�����˵���д������
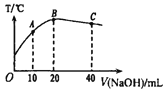
A. ��ˮ�������c(H+)��C��>B��
B. ����ĵ���ƽ�ⳣ����B��> A��
C. ��A�㵽B�㣬�����Һ�п��ܴ��ڣ�c( CH3COO-) = c(Na+)
D. C ������Һ��һ�����ڣ�c(Na+) =2c(CH3COO-) +2c(CH3COOH)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NaHSO3��������֯����л���Ư���Լ���Ⱦ�ϡ���ֽ���Ƹ�ȹ�ҵ��������ԭ����
��1��NaHSO3����NaOH��Һ����SO2�Ƶá�
2NaOH(aq)��SO2(g)==Na2SO3(aq)��H2O(l) ��H1
2NaHSO3(aq)==Na2SO3(aq)��SO2(g)��H2O(l) ��H2
��ӦSO2(g)��NaOH(aq)==NaHSO3(aq)����H3��__________(�ú���H1����H2�Ĵ���ʽ��ʾ)��
��2��NaHSO3�ڲ�ͬ�¶��¾��ɱ�KIO3��������NaHSO3��ȫ���ļ���I2����������I2��������ʱ��������NaHSO3 �ķ�Ӧ���ʡ���Ũ�Ⱦ�Ϊ0.020mol��L-1NaHSO3(����������)10.0 mL��KIO3(����)������Һ40.0 mL��ϣ���¼10��55������Һ����ʱ�䣬55��ʱδ�۲쵽��Һ������ʵ������ͼ��
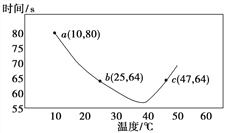
��a��ʱ��v(NaHSO3)��__________mol��L-1��s-1��
��10��40�������ڣ���ɫʱ��Խ��Խ�̣���ԭ����__________��
��3����֪��t��ʱ H2SO3��Ka1��1.5��10-2��Ka2��1.0��10-7��NaHSO3��ҺpH��7����t��ʱ����NaOH��Һ��ͨ��SO2��
����NaHSO3��Һ�м��������������ʺ�c(H2SO3)/c(HSO3-)��ֵ�������______(����ĸ)��
A��H2O B��ϡH2SO4 C��H2O2��Һ D��NaOH��Һ
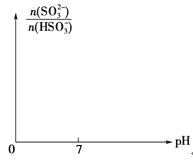
��ijʱ�̣������Һ��pH��6�����ʱ��n(HSO3-)/n(SO32-)��_________��
���뻭���ӿ�ʼͨ��SO2ֱ������ʱ����Һ��n(SO32��)��n(HSO3-)��pH�ı仯����ͼ��_______
��4�������ᡢ����ˮ��Һ������ʽ��е�⣬�ڹ��缫��NO3-��ת��ΪNH2OH���Բ�Ϊ��һ������õ�ⷴӦ�Ļ�ѧ����ʽ_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������20mL Ũ�Ⱦ�Ϊ0.1mol/L (NH4)2SO4��NH4HSO4�����Һ�еμ�0.1mol/L��Ba(OH)2��Һ����ַ�Ӧ���ã���Һ��pH ������Ba(OH)2��Һ����Ĺ�ϵ����ͼ������˵����ȷ����
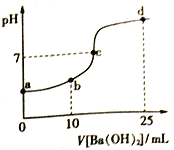
A. a����Һ��: c(NH4+) +c(NH3��H2O)=0.2 mol/L
B. b����Һ��: c(NH4+)>c(SO42-)>c(H+)> c(NH3��H2O)> c(OH-)
C. c����Һ��: c(Ba2+)+ c(NH4+)= c(SO42-)
D. d ����Һ��: c(NH3��H2O)> c(SO42-)>c(NH4+)> c(OH-)> c(H+)
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com