
【题目】NaHSO3被用于棉织物和有机物漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq)+SO2(g)==Na2SO3(aq)+H2O(l) ΔH1
2NaHSO3(aq)==Na2SO3(aq)+SO2(g)+H2O(l) ΔH2
则反应SO2(g)+NaOH(aq)==NaHSO3(aq)的ΔH3=__________(用含ΔH1、ΔH2的代数式表示)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3 的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。
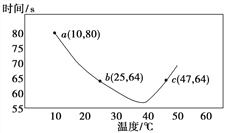
①a点时,v(NaHSO3)=__________mol·L-1·s-1。
②10~40℃区间内,显色时间越来越短,其原因是__________。
(3)已知:t℃时 H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;NaHSO3溶液pH<7。在t℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后,c(H2SO3)/c(HSO3-)的值增大的是______(填字母);
A.H2O B.稀H2SO4 C.H2O2溶液 D.NaOH溶液
②某时刻,测得溶液的pH=6,则此时,n(HSO3-)/n(SO32-)=_________;
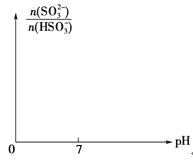
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图。_______
(4)以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的化学方程式_______________。
【答案】 ![]() 5.0×10-5 mol·L-1·s-1 升温反应速率加快,所以变色时间减短 BC 10
5.0×10-5 mol·L-1·s-1 升温反应速率加快,所以变色时间减短 BC 10  2HNO3+2H2O
2HNO3+2H2O![]() 2NH2OH+3O2↑
2NH2OH+3O2↑
【解析】(1)已知:
①2NaOH(aq)+SO2(g)==Na2SO3(aq)+H2O(l) ΔH1
②2NaHSO3(aq)==Na2SO3(aq)+SO2(g)+H2O(l) ΔH2
由盖斯定律:(①-②)/2得到反应SO2(g)+NaOH(aq)==NaHSO3(aq)的△H3=![]() ;
;
(2)①混合后NaHSO3的浓度为0.020molL-1×10/50=0.0040mol/L,反应所用时间为80min,则v=0.0040mol/L÷80min=5.0×10-5molL-1s-1;②升高温度反应速率加快,所以变色时间减小,即10~40℃时,温度升高,NaHSO3和KIO3反应的速率加快,显色时间减小;(3)①NaHSO3中存在水解平衡,其平衡常数为K=c(H2SO3)·c(OH-)/c(HSO3-),K为常数保持不变,则A.加H2O,溶液的pH增大,则c(OH-)增大,所以c(H2SO3)/c(HSO3-)的值减小,A错误;B.加稀H2SO4,溶液的pH减小,则c(OH-)减小,所以c(H2SO3)/c(HSO3-)的值增大,B正确;C.H2O2溶液与HSO3-反应生成NaHSO4,溶液的酸性增强,则c(OH-)减小,所以c(H2SO3)/c(HSO3-)的值增大,C正确;D.加NaOH溶液,溶液的pH增大,则c(OH-)增大,所以c(H2SO3)/c(HSO3-)的值减小,D错误;答案选BC;②NaHSO3中存在电离平衡HSO3-![]() SO32-+H+,亚硫酸的K2=c(SO32)c(H+)/c(HSO3)=1.0×10-7,则c(HSO3-)/c(SO32-)=1.0×106/1.0×107=10,所以n(HSO3-)/n(SO32-)=10;③往NaOH溶液中通入SO2至过量,溶液中发生的反应为:2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大,所以n(SO32-)∶n(HSO3-)随pH的增大而增大,其变化图为
SO32-+H+,亚硫酸的K2=c(SO32)c(H+)/c(HSO3)=1.0×10-7,则c(HSO3-)/c(SO32-)=1.0×106/1.0×107=10,所以n(HSO3-)/n(SO32-)=10;③往NaOH溶液中通入SO2至过量,溶液中发生的反应为:2NaOH+SO2=Na2SO3+H2O,Na2SO3+H2O+SO2=2NaHSO3,溶液中碱性越强,则SO32-的浓度越大,所以n(SO32-)∶n(HSO3-)随pH的增大而增大,其变化图为 。(4)在汞电极上NO3-可转化为NH2OH,氮元素化合价从+5价降低到-1价,得到电子,因此另一极应该是溶液中的氢氧根失去电子转化为氧气,所以该电解反应的化学方程式为2HNO3+2H2O
。(4)在汞电极上NO3-可转化为NH2OH,氮元素化合价从+5价降低到-1价,得到电子,因此另一极应该是溶液中的氢氧根失去电子转化为氧气,所以该电解反应的化学方程式为2HNO3+2H2O![]() 2NH2OH+3O2↑。
2NH2OH+3O2↑。


 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】下列措施可以提高燃料燃烧效果的是( ) ①固体燃料粉碎 ②液体燃料雾化 ③煤经气化处理 ④通入足量的空气.
A.①③
B.①②③
C.①③④
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“探险队员” 盐酸,不小心走进了化学迷宫,不知怎样走出来,因为迷宫有许多“吃人的野兽”(即能与盐酸反应的物质或者是水溶液),盐酸必须避开它们,否则无法通过。
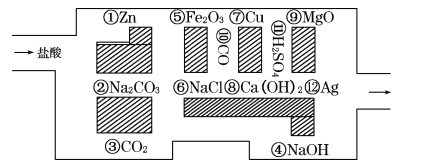
(l)请你帮助它走出迷宫(请用图中物质前的序号连接起来表示所走的路线):盐酸→___ → ___→⑩→⑦→___ →
(2)在能“吃掉”盐酸的化学反应中,属于非氧化还原反应的有 ___个,能“吃掉”盐酸的盐与足量的盐酸发生反应的离子方程式为____。
(3)在不能与盐酸反应的物质中,属于电解质的是______(填物质前的序号,下同),属于非电解质的是 ___,熔融状态能导电的是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有0.1mol/L的NH4HCO3溶液,pH=7.8。已知含氮(或含碳)各微粒的分布分数(平衡时某种微粒的浓度占各种微粒浓度之和的分数)与pH的关系如下图所示。下列说法正确的是:

A.当溶液的pH=9时,溶液中存在下列关系:c(NH4+)>c(HCO3-)>c(NH3·H2O)>c(CO32-)
B.NH4HCO3溶液中存在下列守恒关系:c(NH4+)+c(NH3·H2O)+c(H+)=c(OH-)+2c(CO32-)+c(H2CO3)
C.往该溶液中逐滴滴加氢氧化钠时NH4+和HCO3-浓度逐渐减小
D.通过分析可知常温下Kb(NH3·H2O)>Ka1(H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有K+、Na+、Fe3+、Fe2+、SO42-、CO32-、I-、Cl-中的一种或多种,进行如图所示的实验,下列说法正确的是 ( )

A. 溶液X中有Fe3+、SO42-
B. 溶液X中有Fe2+、I-可能有SO42-、Cl-
C. 溶液X中有I-、Cl-,无CO32-
D. 溶液X中有I-,Fe2+和Fe3+两种离子中至少有一种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋植物如:海带、海藻中含有丰富的碘元素,碘元素经过灼烧之后以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②③设计成如下流程:

已知:实验②中发生反应的离子方程式:2I-+ H2O+2H+=2H2O+I2。回答下列问题:
(1)写出提取流程中实验③的操作名称:_____ ,从E到F的正确操作方法为:_______,实验①的操作为过滤,如果滤液仍然浑浊应该采取的措施是:___.
(2)从F的下层液体中得到固态碘单质还需要进行的操作是:____。
(3)当实验②中的反应转移的电子数为2.408×1023时,理论上可以提取___mol I2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差,实验测得m(H)∶m(O)>1∶8。下列对导致这一结果的原因的分析中,一定错误的是

A. Ⅰ、Ⅱ装置之间缺少干燥装置 B. CuO没有全部被还原
C. Ⅱ装置中玻璃管内有水冷凝 D. Ⅲ装置后缺少干燥装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列会引起中毒甚至死亡的是
①用工业酒精兑水假冒白酒 ②用福尔马林浸泡海参使食物保鲜
③用无碘盐假冒碘盐 ④用亚硝酸钠假冒食盐
⑤用盛过农药的桶装工业用油假冒食用油
A. ①②③④ B. ①②④⑤ C. ②③④⑤ D. ①③④⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向60mLNa2SO4溶液中加入BaCl2溶液,有关数据见下表,下列有关说法正确的是
实验编号 | 1 | 2 | 3 | 4 | 5 |
BaCl2溶液体/ mL | 0 | 30 | 60 | 100 | 120 |
沉淀质量/g | 0 | 0.699 | x | 2.097 | 2.097 |
A. 混合前,BaCl2溶液的物质的量浓度为0.05 mol/L
B. 混合前,Na2SO4溶液的物质的量浓度为0.30 mol/L
C. 实验3中沉淀的质量x为1.398g
D. 完全沉淀60mLNa2SO4溶液,消耗BaCl2溶液的体积为80mL
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com