
【题目】海洋植物如:海带、海藻中含有丰富的碘元素,碘元素经过灼烧之后以碘离子的形式存在。实验室里从海藻中提取碘的流程如下:
![]()
某化学兴趣小组将上述流程②③设计成如下流程:

已知:实验②中发生反应的离子方程式:2I-+ H2O+2H+=2H2O+I2。回答下列问题:
(1)写出提取流程中实验③的操作名称:_____ ,从E到F的正确操作方法为:_______,实验①的操作为过滤,如果滤液仍然浑浊应该采取的措施是:___.
(2)从F的下层液体中得到固态碘单质还需要进行的操作是:____。
(3)当实验②中的反应转移的电子数为2.408×1023时,理论上可以提取___mol I2。
【答案】萃取 用一手压住分液漏斗口部,另一手握住活塞部分,把分液漏斗倒转过来振荡,振荡后打开活塞,使漏斗内气体放出 重新过滤(至无混浊) 蒸馏 0.2mol
【解析】
(1)根据提取流程可知,实验③中的操作为萃取;从E到F的正确操作方法为:用一手压住分液漏斗口部,另一手握住活塞部分,把分液漏斗倒转过来振荡,振荡后打开活塞,使漏斗内气体放出;实验①的操作为过滤,如果滤液仍然浑浊应该采取的措施是:重新过滤,至无混浊;综上所述,本题答案是:萃取 ;用一手压住分液漏斗口部,另一手握住活塞部分,把分液漏斗倒转过来振荡,振荡后打开活塞,使漏斗内气体放出;重新过滤(至无混浊)。
(2)分液后从有机溶剂中提取碘,需要用蒸馏操作,因此,本题正确答案是:蒸馏。
(3)根据电子得失守恒可知,2I-→I2,生成1molI2失电子2mol,当实验②中的反应转移的电子数为2.408×1023时,转移电子的物质的量为0.4 mol,理论上可以提取0.2mol I2。综上所述,本题答案是:0.2mol。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】充分燃烧2.8g某有机物A,生成8.8g CO2和3.6g H2O,这种有机物蒸气的相对密度是相同条件下N2的2倍。
(1)求该有机物的分子式。
(2)该有机物链状同分异构体的结构简式为: 。
(3)若在核磁共振氢谱中只有一个信号峰(即只有一种氢原子),则用键线式表示的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质可用于杀菌消毒的是
①臭氧 ②苯酚 ③酒精 ④硫黄 ⑤福尔马林 ⑥双氧水
A. ①②③④⑤⑥ B. ③⑥ C. ①⑤⑥⑦ D. ①②③⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaHSO3被用于棉织物和有机物漂白以及在染料、造纸、制革等工业中用作还原剂。
(1)NaHSO3可由NaOH溶液吸收SO2制得。
2NaOH(aq)+SO2(g)==Na2SO3(aq)+H2O(l) ΔH1
2NaHSO3(aq)==Na2SO3(aq)+SO2(g)+H2O(l) ΔH2
则反应SO2(g)+NaOH(aq)==NaHSO3(aq)的ΔH3=__________(用含ΔH1、ΔH2的代数式表示)。
(2)NaHSO3在不同温度下均可被KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3 的反应速率。将浓度均为0.020mol·L-1NaHSO3(含少量淀粉)10.0 mL、KIO3(过量)酸性溶液40.0 mL混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图。
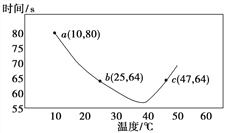
①a点时,v(NaHSO3)=__________mol·L-1·s-1。
②10~40℃区间内,显色时间越来越短,其原因是__________。
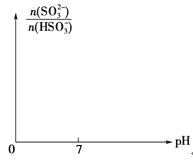
(3)已知:t℃时 H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7;NaHSO3溶液pH<7。在t℃时,往NaOH溶液中通入SO2。
①在NaHSO3溶液中加入少量下列物质后,c(H2SO3)/c(HSO3-)的值增大的是______(填字母);
A.H2O B.稀H2SO4 C.H2O2溶液 D.NaOH溶液
②某时刻,测得溶液的pH=6,则此时,n(HSO3-)/n(SO32-)=_________;
③请画出从开始通入SO2直至过量时,溶液中n(SO32-)∶n(HSO3-)随pH的变化趋势图。_______
(4)以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3-可转化为NH2OH,以铂为另一极,则该电解反应的化学方程式_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列指定反应的离于方程式正确的是
A. 向氯化铝溶液中滴加过量氨水:Al3++4NH3·H2O=AlO2-+4NH4++2H2O
B. 浓盐酸与MnO2反应制取Cl2:MnO2+4HCl(浓) ![]() Mn2++2Cl-+Cl2↑+2H2O
Mn2++2Cl-+Cl2↑+2H2O
C. 酸性条件下,碘化钾溶液露置于空气中变质:4H++4I-+O2=2I2+2H2O
D. 向Ca(HCO3)2溶液中加入少量Ca(OH)2溶液:HCO3-+OH-=CO32-+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一个密闭容器,中间有一可自由滑动的隔板(厚度可忽略)将容器分成两部分,当左侧充入1 mol N2,右侧充入CO和CO2的混合气体共8 g时,隔板处于如图位置(左、右两侧温度相同),下列说法正确的是
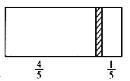
A. 右侧CO与CO2分子数之比为1∶3
B. 右侧气体密度是相同条件下氢气密度的18倍
C. 右侧CO的质量为1.75 g
D. 若隔板处于距离右端1/6处,其他条件不变,则前后两次压强之比为25∶24
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“铜都”安徽铜陵有许多黄铜矿(主要成分为CuFeS2,含少量Al2O3、SiO2),黄铜矿是制取铜及其化合物的主要原料之一,还可制备硫及铁的化合物。
(1)火法炼铜首先要焙烧黄铜矿,其反应原理为2CuFeS2+O2![]() Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
Cu2S+2FeS+SO2。CuFeS2中Cu和Fe元素的化合价均为+2价,若反应中转移0.3mol电子时,则标准状况下,产生SO2的体积为________L。
(2)焙烧黄铜矿产生的Cu2S可被稀硝酸氧化为Cu2+ 和硫单质,HNO3的还原产物为NO,试写出Cu2S与稀硝酸反应的离子方程式,并用双桥式表示电子转移__________________。
(3)焙烧黄铜矿还可得到Cu2O,将21.6g Cu2O加入到500mL某浓度的稀硝酸中,固体物质完全反应,生成Cu(NO3)2和NO,在所得溶液中加入1.0molL-1的NaOH溶液1.0L,此时溶液呈中性。原硝酸的物质的量浓度为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂以丙烯、乙烯为原料进行化工生产的主要流程如下。下列有关说法错误的是( )
![]() ,其中
,其中![]()
A.反应①与反应④均是取代反应
B.反应②与反应③均是加成反应
C.反应②中产物的结构简式为CH2BrCH2CHClBr
D.反应③、④表明硫酸是乙烯与水反应的催化剂
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com