
����Ŀ����������﮵����һ�ָ߹��ʶ�����ء����÷Ͼ�����ӵ�ػ��չ����Ʊ������������Ԫ��������(���缫����Ϳ��LiNi1��x��yCoxMnyO2)�Ĺ���������ͼ��ʾ��
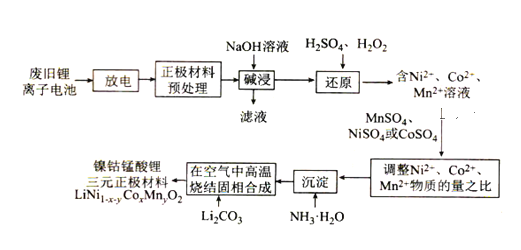
�ش���������
��1���Ͼ�����ӵ�ز��ǰ�������ŵ紦������������������Ļ��գ���ԭ����___��
��2���ܹ�����������Ч�ʵķ�����___(����д����)��
��3��������������У����ܽ⣬�ڸ÷�Ӧ��ÿ����1mol�Ǽ��Թ��ۼ��ų�133.3kJ����������д���÷�Ӧ���Ȼ�ѧ����ʽ___��
��4��ʵ����ģ�������������˵IJ��������˺���ϴ�ӣ�����ϴ�ӵIJ������̣�___��
��5��LiCoO2��������ԭ����Ӧ�����ӷ���ʽΪ___���ڸ÷�Ӧ��H2O2��___������������ԭ����1molH2O2���뷴Ӧת��__ NA������
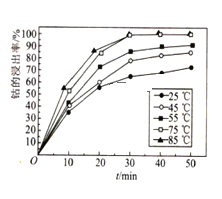
��6����Һ�¶Ⱥͽ���ʱ����ܵĽ�����Ӱ����ͼ��ʾ����������̵����������___��
��7����֪��Һ��Co2+��Ũ��Ϊ1.0mol��L��1������ͨ�백����ʹ�����Co(OH)2��������Co2+������ȫʱ��Һ����СpHΪ____(��֪�����ӳ�����ȫʱc(Co2+)��1.0��10��5mol��L��1��Ksp[Co(OH)2]=4.0��10��15��1g5=0.7��1g2=0.3����Һ����仯���Բ���)��
���𰸡��ŵ�������Li+�������ƶ��������������� ���顢�ʵ�����NaOH��Ũ�ȡ��ʵ������¶ȵ� 2Al(s)+2H2O(l)+2NaOH(aq)=2NaAlO2(aq)+3H2(g) ��H=-399.9kJ/mol �ز�������������м�ˮ����û��������ˮ�˳����ظ�����2~3�� 2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2�� ��ԭ�� 2 75�棬30min 9.3
��������
���÷Ͼ�����ӵ�ػ��չ����Ʊ������������Ԫ�������ϣ����Ͼ�����ӵ����������Ԥ����������NaOH��Һ��ȡ���ˣ��������H2SO4��H2O2���õ�����Ni2����CCo2����Mn2������Һ����Һ�м���MnSO4��NiSO4��CoSO4��������������һˮ�ϰ����õ��������ټ���Li2CO3���õ��������ϡ�
(1)�Ͼ�����ӵ�ز��ǰ���С��ŵ紦������������������Ļ��գ���ԭ���ǣ��ŵ�������Li���������������������������ϣ�
(2)��߽�ȡ��Ч�ʣ��ӿ컯ѧ��Ӧ���ʣ����Է��飬�ʵ���������������Һ��Һ��Ũ�ȣ��ʵ���߷�Ӧ�¶ȵȣ�
(3)������NaOH������NaAlO2��H2����ѧ����ʽΪ2Al��2NaOH��2H2O=2NaAlO2��3H2����ÿ����1mol�Ǽ��Լ�����ÿ����1molH2���ų�133.3kJ���������Ȼ�ѧ����ʽΪ2Al(s)+2H2O(l)+2NaOH(aq)=2NaAlO2(aq)+3H2(g) ��H=-399.9kJ/mol��
(4) �ز�������������м�ˮ����û��������ˮ�˳����ظ�����2~3�Σ�
(5) LiCoO2��Li�Ļ��ϼ�Ϊ��1��Co�Ļ��ϼ�Ϊ��3������H2O2��H2SO4�У�Co�Ļ��ϼ۽��͵���2����H2O2��O�Ļ��ϼ����ߣ��ӣ�1���ߵ�0������O2�����ݵ�ʧ�����غ㣬�͵���غ㣬���ӷ���ʽΪ2LiCoO2+6H++H2O2=2Li++2Co2++4H2O+O2����H2O2��O�Ļ��ϼ����ߣ�����ԭ����H2O2��O�Ļ��ϼ����ߣ��ӣ�1���ߵ�0��1molH2O2���뷴Ӧת��2mol���ӣ���ת��2NA�����ӣ�
(6)�¶Ȳ���Խ��Խ�ã��¶ȸߣ�����ʱ���ܸߣ���ͼ�п�֪����30minʱ��85���75�棬Co�Ľ����ʾ���ߣ�ѡ���¶Ƚϵ͵ģ���С���ܣ���Ϊ75����30min��
(7) ���ӳ�����ȫʱc(Co2+)��1.0��10��5mol��L��1��Ksp[Co(OH)2]=c(Co2��)c2(OH��),��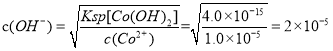 ��
��![]() ��pH=-lg(H+)=-lg(5��10-10)=-lg5+10=9.3��
��pH=-lg(H+)=-lg(5��10-10)=-lg5+10=9.3��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
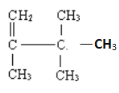
����Ŀ��������Һ�п��Է��������������ЧӦ�Ļ�ѧ���ʡ����������ᣬ��������Ľṹ��ʽ��ͼ��ʾ�������й�˵����ȷ���ǣ� ��
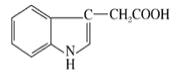
A.�����к���2�ֹ�������������
B.1mol������������������������Ӧ���������5molH2.
C.�������ᱽ���ϵĶ��ȴ��ﹲ������
D.�����к�һ������̼ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ���ǣ� ��
A.Al��SiO2��Ca(OH)2��NaHCO3�ȼ��������ᷴӦ������������������Һ��Ӧ
B.��a��b��c�քeΪSi��SiO2��H2SiO3�����ͨ��һ����Ӧʵ����ͼ��ת����ϵ
![]()
C.Fe2O3![]() Fe2(SO4)3(aq)
Fe2(SO4)3(aq)![]() ��ˮFe2(SO4)3
��ˮFe2(SO4)3
D.S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��д�����з�Ӧ�Ļ�ѧ����ʽ�����ƣ�
��1-�嶡�������������Ҵ���Һ���ȣ�_________________________________________________
��2-��-1,3-����ϩ������ʵ����ĵ�������60��ʱ����1,4-�ӳɷ�Ӧ��_________________
�ۼױ��Ʊ�TNT�ķ�Ӧ��____________________________________________________
�� ����ϵͳ������������ ____________________________________________
����ϵͳ������������ ____________________________________________
�� 2��6��������4���һ����飨д���ṹ��ʽ��_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��FΪ��ѧ��ѧ�����ĵ��ʻ������A��FΪ���ʣ������£�E��Ũ��Һ��ʹ�������ۻ����ת����ϵ��ͼ��ʾ����������ȥ��������������⣺

��1����AΪ����ɫ���壬BΪ���壬FΪ�ǽ������ʡ�
��д��Eת��ΪC�Ļ�ѧ����ʽ________________________________��
��B�ڿ�������ʹ��������ʧȥ����������ڣ��÷�Ӧ���������ͻ�ԭ��֮��Ϊ_____��
��2����BΪ��ʹʪ��ĺ�ɫʯ����ֽ���������塣
��B��E��Ӧ�õ��IJ����������Ļ�ѧ������Ϊ____________________��
������������Ӧ����Թܿ���E��ϡ��Һ��ϴ����Ӧ�����ӷ���ʽΪ___________________��
���ڸ���״̬�£���ڷ�Ӧ�õ���������ͨ�������������õ�N2O5��һ�����嵥�ʣ�д����Ӧ�Ļ�ѧ����ʽ______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��3-��-1-�嶡���3-��-2-�嶡��ֱ���NaOH���Ҵ���Һ���ȣ���������Ӧ��˵����ȷ����( )
A.������ͬ����Ӧ������ͬB.���ﲻͬ����Ӧ������ͬ
C.̼������ѵ�λ����ͬD.̼������ѵ�λ����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ�Խ̲���̽���������ʵ�ʵ�飨ͼ1�������˸Ľ�����ͼ2��ʾ���Թܱ�����һ��ÿ��1cm����һ�η�̪��Һ����ֽ����װ������Ũ��ˮ�ij���Сҩƿ�̶�����Ƥ���ϡ�����ͼ1ͼ2�е�ʵ��������˵����������ȷ���ǣ� ��
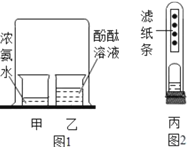
��ͼ2��ͼ1��ʵ������˴�����Ⱦ������Լ
��ͼ1��ͼ2��ʵ�����֤�������ڲ����˶�
��ͼ2�й۲쵽����������ֽ���ϵķ�̪��Һ���϶������α��
������ȡ�����ͬ��װ�ý���10�����ˮ�У����ܵó�����
A.�٢�B.�٢ڢ�C.�٢ڢۢ�D.�ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ư���dz�������������ʵ���ҿ�������ͼ��ʾװ����ȡ��
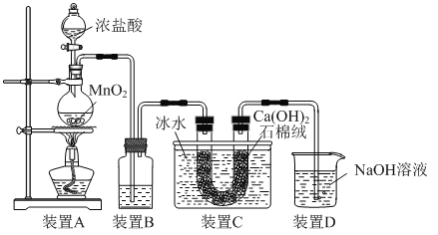
(1)װ��A����������Ӧ�Ļ�ѧ����ʽΪ_____��
(2)Ϊ��ȥ�ӷ�����HCl��װ��B��Ӧװ��_____��
(3)װ��C����������Ӧ�Ļ�ѧ����ʽΪ_____��
(4)װ��D��������_____��
(5)��Ч�Ⱥ����Ǻ�����������������������Ҫָ�ꡣ�������ε���Ч�Ⱥ������ô������������ᷴӦ�����ɵ������ĺ�����ʾ��Cl����ClO����2H��=Cl2��H2O[��Ч�Ⱥ�����![]() ��100%]��Ϊ�ⶨװ��C������Ư�۵���Ч�Ⱥ�������������ʵ�飺ȷ��ȡװ��C������Ư��1.775g��������Ũ���ᷴӦ������Cl2�ڱ�״���µ����Ϊ0.112L������Ư�۵���Ч�Ⱥ�������д���������_____��
��100%]��Ϊ�ⶨװ��C������Ư�۵���Ч�Ⱥ�������������ʵ�飺ȷ��ȡװ��C������Ư��1.775g��������Ũ���ᷴӦ������Cl2�ڱ�״���µ����Ϊ0.112L������Ư�۵���Ч�Ⱥ�������д���������_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ������Ʊ�һϵ������(��ͼ��ʾ)������˵���������( )
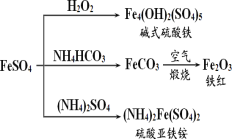
A.��ʽ������ˮ���ܲ��� Fe(OH)3 ���壬��������ˮ��
B.Ϊ��ֹ NH4HCO3 �ֽ⣬���� FeCO3 ���ڽϵ��¶��½���
C.�����£�(NH4)2Fe(SO4)2 ��ˮ�е��ܽ�ȱ� FeSO4 �Ĵ�
D.���� KSCN ��Һ����(NH4)2Fe(SO4)2 �Ƿ�����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com