
【题目】取4.64g铁屑(含有Fe2O3、CuO杂质),加入足量的稀硫酸溶解,产生标准状况下气体V mL,过滤后得到0.64g残渣和滤液M(无Cu2+)。在滤液M中加入足量NaOH溶液过滤残渣充分灼烧得到4.80g固体。请计算:
(1)滤液M中存在的金属阳离子有____。
(2)参与反应的硫酸的物质的量为___mol。
(3)V=____。
【答案】Fe2+ 0.06 448 mL
【解析】
(1)加入足量的稀硫酸溶解,过滤后得到0.64g残渣,且滤液M无Cu2+,由于硫酸足量,Fe、Cu能与Fe3+反应,则残渣为Cu,滤液M中金属阳离子为Fe2+;
(2)滤液M中溶质为FeSO4,加入足量的NaOH,由于氢氧化亚铁易被氧化,过滤充分灼烧得到4.80g固体为Fe2O3,根据Fe原子守恒计算硫酸亚铁的物质的量,再根据硫酸根守恒计算硫酸的物质的量;
(3)纵观整个反应过程,原混合物可以看作FeO、Cu、Fe的混合物,其中FeO、Fe的总质量为4.64g-0.64g=4g,由Fe原子守恒可知FeO、Fe的总物质的量,联立计算各自物质的量,根据电子转移守恒计算氢气的体积。
(1)加入足量的稀硫酸溶解,过滤后得到0.64g残渣,且滤液M无Cu2+,由于硫酸足量,Fe、Cu能与Fe3+反应,则残渣为Cu,滤液M中金属阳离子为Fe2+,故答案为:Fe2+;
(2)滤液M中溶质为FeSO4,加入足量的NaOH,由于氢氧化亚铁易被氧化,过滤充分灼烧得到4.80g固体为Fe2O3,其物质的量为![]() =0.03mol,根据Fe原子守恒,n(FeSO4)=2n(Fe2O3)=0.03mol×2=0.06mol,因此n(H2SO4)=n(FeSO4)=0.06mol,故答案为:0.06;
=0.03mol,根据Fe原子守恒,n(FeSO4)=2n(Fe2O3)=0.03mol×2=0.06mol,因此n(H2SO4)=n(FeSO4)=0.06mol,故答案为:0.06;
(3)纵观整个反应过程,原混合物可以看作FeO、Cu、Fe的混合物,其中FeO、Fe的总质量为4.64g-0.64g=4g,则72g/mol×n(FeO)+56g/mol×n(Fe)=4g,Fe元素最终都转移到4.80g固体为Fe2O3中,由Fe原子守恒可知:n(FeO)+n(Fe)=0.06mol,联立解得:n(FeO)=0.04mol、n(Fe)=0.02mol,根据电子转移守恒可知生成氢气为![]() =0.01mol,则得到氢气体积为0.01mol×22.4L/mol=0.224L,即体积为224mL,故答案为:224 mL。
=0.01mol,则得到氢气体积为0.01mol×22.4L/mol=0.224L,即体积为224mL,故答案为:224 mL。


科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A.原子数目相等的三种气体,质量最大的是Z
B.同温同压下,同质量的三种气体,气体密度最小的是X
C.同温同压下,三种气体体积均为6.72 L,则它们的物质的量一定均为0.3 mol
D.同温下,体积相同的两容器分别充入2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、容积为2L的密闭容器中通入1mol X和2mol Y,发生反应:X(s)+2Y(g) ![]() 3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
3Z(g) ΔH=-a kJ/mol (a>0),5min末测得Z的物质的量为1.2mol。则下列说法正确的是
A. 若反应体系中气体的压强保持不变,说明反应达到了平衡状态
B. 0~5min,X的平均反应速率为0.04mol ·L-1·min-1
C. 达到平衡时,反应放出的热量为a kJ
D. 达到平衡时,Y和Z的浓度之比一定为2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)“水玻璃”中溶质的化学式为____,乙二醇的结构简式为____。
(2)AlCl3熔沸点较低,熔融状态不导电,则其晶体类型为____晶体。
(3)浓硝酸需避光保存在棕色试剂瓶的原因是____。(用化学方程式解释)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第19届亚洲运动会将于2022年在杭州举行,杭州的空气与水质量的提高越来越成为人们关注的问题。其中,烟气中的NOx与水中总氮含量(包括有机氮及NO3-、NO2-、NH4+等无机氮)都必须脱除(即脱硝)后才能排放。请回答下列问题:
I.空气的脱硝处理:
已知:CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1= -890.3.kJ· mol-1
N2(g)+O2(g)=2NO(g) ΔH2= +180.kJ· mol-1
(1)CH4可用于脱硝,其化学方程式为CH4(g)+4NO(g)![]() CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
CO2(g)+2N2(g)+2H2O(l),ΔH=____kJ· mol-1。在恒温,恒容的密闭容器中通入2mol CH4和4mol NO,下列说法正确的是____。
A.甲烷过量,可将NO完全转化为N2
B.从反应开始到平衡的过程中,NO的转化率一直增大
C.反应过程中,容器中的压强保持不变
D.平衡后,再通入一定量的甲烷,正反应速率增大
(2)C2H4也可用于烟气脱硝。为研究温度、催化剂中Cu2+负载量对其NO去除率的影响,控制其他条件一定,实验结果如图1所示。为达到最高的NO去除率,应选择的反应温度和Cu2+负载量分别是____。
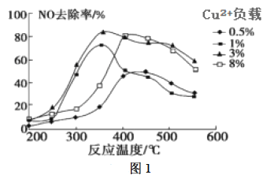

II.水的脱硝处理:
(3)水中的含氮物质在好氧硝化菌的作用下有如下反应:
2NH4+(aq)+3O2(g)=2NO2-(aq)+4H+(aq)+2H2O(l)(快反应)
2NO2-(aq)+O2(g)=2NO3-(aq)(慢反应)
20℃时含氮废水(以NH4+)的NH4+的浓度随DO(水体中溶解氧)浓度的变化曲线如图2所示,在图2上画出20℃时NO2-的浓度随DO的变化趋势图。_______
(4)研究表明,用电解法除去氨氮废水(反应中视为NH4+)有很高的脱氮(转化为N2)效率,写出该过程中阳极的电极反应式____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求计算、整理化简并填空:
(1)若20g密度为ρgcm﹣3的硝酸钙溶液里含1gCa2+,则NO3-的物质的量浓度是____。
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg/mol。若阿伏加德罗常数的值用NA表示,则:
①该气体所含原子总数为___个。
②该气体在标准状况下的体积为____L。
③该气体溶于1L水中(不考虑反应),形成的溶液密度为ρg/cm3,则该溶液的物质的量浓度为____molL-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上制备高纯硅有多种方法,其中的一种工艺流程如下:
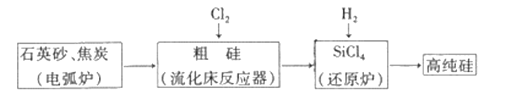
已知:流化床反应的产物中,除SiCl4外,还有SiHCl3、SiH2Cl2、SiH3Cl、FeCl3等。下列说法正确的是
A. 电弧炉中发生的反应为C+SiO2![]() CO2↑+Si
CO2↑+Si
B. SiCl4进入还原炉之前需要经过蒸馏提纯
C. 每生产l mol高纯硅,需要44. 8L Cl2(标准状况)
D. 该工艺Si的产率高,符合绿色化学要求
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知下列反应:2CO(g)+O2(g)=2CO2(g) ΔH=-566kJ·mol-1,Na2O2(s)+CO2(g)=Na2CO3(s)+ ![]() O2(g) ΔH=-266kJ·mol-1,试回答:
O2(g) ΔH=-266kJ·mol-1,试回答:
(1)CO的燃烧热ΔH=_______________。
(2)在催化剂作用下,一氧化碳可与过氧化钠反应生成固体碳酸钠,该反应的热化学方程式为:________。
(3)工业废气中的CO2可用碱液吸收,所发生的反应如下:CO2(g)+2NaOH(aq)=Na2CO3(aq)+H2O(l) ΔH=-a kJ·mol-1,CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-bkJ·mol-1,则:
①CO2(g)+H2O(l)+Na2CO3(aq)=2NaHCO3(aq)的ΔH=________kJ·mol-1(用含a、b的代数式表示)。
②标况下,11.2LCO2与足量的NaOH溶液充分反应后,放出的热量为_______kJ(用含a或b的代数式表示)。
(4)根据以下三个热化学方程式:2H2S(g)+3O2(g)= 2SO2 (g) +2H2O (l) ΔH=-Q1kJ·mol-1,2H2S(g)+O2(g)= 2S (s) +2H2O (l) ΔH=-Q2kJ·mol-1,2H2S(g)+O2(g)=2 S (s) +2H2O (g) ΔH=-Q3kJ·mol-1,判断Q1、Q2、Q3的大小关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组欲探究浓硝酸的性质。
Ⅰ.木炭与浓硝酸反应:
(1)甲同学设计了图1装置,认为若有红棕色气体产生就说明木炭与浓硝酸发生了反应。写出木炭与浓硝酸反应的化学方程式____________________________。

(2)乙同学认为红棕色气体不能作为木炭与浓硝酸反应的证据,其理由是________。
(3)乙同学设计了图2装置实验,木炭能燃烧,并产生红棕色气体。针对该实验现象,乙同学做出如下假设:
假设a:_____________________________;
假设b:红热木炭使HNO3分解产生NO2,NO2可能具有助燃性,木炭燃烧;
假设c:红热木炭使HNO3分解产生O2,木炭与O2反应燃烧;
假设d:红热木炭使HNO3分解产生NO2和O2,共同影响木炭的燃烧;……
(4)设计实验证明假设b成立,请将实验方案补充完整。
①实验方法:_____________________________________________________。
实验现象:木炭在该气体中持续燃烧,火焰迅速变亮,集气瓶中气体颜色变浅直至无色,产生的气体能使澄清石灰水变浑浊,且遇空气不变色。
②根据实验现象写出木炭与此气体反应的化学方程式__________________。
Ⅱ.设计硝酸在不同条件下分解实验,方案见下表:
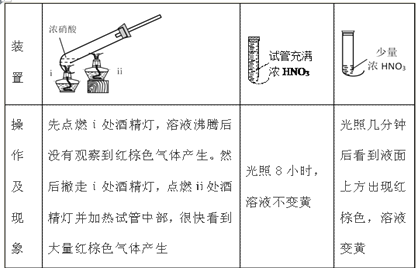
(5)分析上述现象,得出使硝酸成功分解的关键是____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com