
【题目】已知某+2价离子的电子排布式为1s22s22p43s23p43d10,该元素在周期表中所属的族是( )
A. ⅡA B. ⅡB C. ⅤⅡ D. ⅠB
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G(![]() )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①![]() ;
;
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。回答下列问题:
(1)A的化学名称为 。
(2)B和C反应生成D的化学方程式为 。
(3)F中含有官能团的名称为 。
(4)E和F反应生成G的化学方程式为 ,
反应类型为 。
(5)F的同分异构体中不能与金属钠反应生成氢气的共有 种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为3:1的为 (写结构简式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对化学工业和国防工业具有重要意义,对农业生产起着重要作用。
(1)已知:N2(g)+O2(g)=2NO(g) △H1
H2(g)+1/2O2(g)=H2O(1) △H2
4NH3(g)+5O2(g)=4NO(g)+6H2O(1) △H3
N2(g)+3H2(g)2NH3(g) △H4<0
则△H4= (用含△H1、△H2、△H3的代数式表示)。
(2)在其他条件相同时,分别测定合成氨反应中N2的平衡转化率随压强变化的曲线如下图A、B所示,其中正确的是 (填“A”或“B”),其判断理由是 。
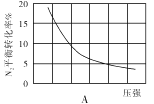
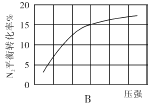
(3)在体积为2L的密闭容器中按物质的量1:3的比例充入N2、H2,进行下列四组合成氨实验:
组别 | 温度 | N2起始量/mol | N2的物质的量/mol | ||||||
5(s) | 10(s) | 15(s) | 20(s) | 25(s) | 30(s) | 35(s) | |||
Ⅰ | T1 | 0.1 | 0.094 | 0.089 | 0.085 | 0.0825 | 0.081 | 0.080 | 0.080 |
Ⅱ | T2 | 0.1 | 0.090 | 0.085 | 0.082 | 0.080 | 0.080 | 0.080 | 0.080 |
Ⅲ | T3 | 0.2 | 0.179 | 0.165 | 0.153 | 0.146 | x | x | x |
Ⅳ | T4 | 0.2 | 0.173 | 0.161 | 0.155 | 0.150 | 0.150 | 0.150 | 0.150 |
①实验Ⅰ前10秒的平均速率v(NH3)= mol·L-1·s-1,T1温度下合成氨反应的平衡常数K= (列出计算式)。
②与实验Ⅰ相比,实验Ⅱ改变了一个条件,该条件可能是 。
③与实验I相比,实验Ⅲ中N2的平衡转化率 (填“增大”、“减小”或“不变”),平衡常数K (填“增大”、“减小”或“不变”)。
④实验Ⅲ与实验Ⅳ的反应条件温度不同,则T1 (填“大于”、“小于”或“等于”)T2,原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜及其化合物在日常生活中应用广泛。某研究性学习小组欲从氯化铁溶液腐蚀印刷电路极后的酸性废液中(含FeCl3、FeCl2含CuCl2)制备氯化铜晶体(CuCl2·2H2O),设计路线如下:
![]()
回答下列问题:
(1)检验酸性废液中含有Fe3+,常用的试剂是 (填化学式);酸性废液中加入足量Cl2,反应的化学方程式为 。
(2)操作1的名称是 ;调节溶液的pH时适宜选用下列试剂中的 ;
A.NaOH溶液 B.Na2CO3 C.氨水 D.CuO
若调节溶液的pH为4时,溶液中残留的Fe3+物质的量浓度为 (已知25℃时,Kap[Fe(OH)3]=4×10-38).
(3)操作2需在氯化氢气流中经过加热浓缩、 、过滤、洗涤、干燥。在氯化氢气流中进行操作的原因是 (结合离子方程式并简要说明)。
(4)若在溶液2中通入一定量的SO2,加热,则生成CuCl沉淀,该反应的离子方程式为 。
(5)该小组设想以铜棒和石墨棒为电极,以KI溶液为电解液,利用电解来制取碘化亚铜,
已知:2Cu2++4I-=2CuI↓+I2.若按其设想,铜棒应连接电源的 (填“正”或“负”)极;阴极发生的电极反应式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关非金属及其化合物的说法正确的是( )
A. 硅酸可使紫色石蕊试液变红色
B. 二氧化硫通入紫色石蕊试液中.试液先变红后褪色
C. 可用锌粒与稀硝酸反应制备氢气
D. 液溴易挥发,所以存放液溴的试剂瓶中应加水封保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中发生化学反应H2(g)+I2(g)2HI(g),05min内H2的浓度减少了0.1mol/L,则在这段时间内,用HI表示的平均反应速率为( )
A.0.01molL-1min-1 B.0.2molL-1min-1
C.0.04molL-1min-1 D.0.5molL-1min-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com