
A.C8H18(l)+![]() O2(g)
O2(g) ![]() 8CO2(g)+9H2O(g);ΔH=-48.40 kJ· mol-1
8CO2(g)+9H2O(g);ΔH=-48.40 kJ· mol-1
B.C8H18(l)+ ![]() O2(g)
O2(g) ![]() 8CO2(g)+9H2O(l);ΔH=-5 518 kJ· mol-1
8CO2(g)+9H2O(l);ΔH=-5 518 kJ· mol-1
C.C8H18(l)+ ![]() O2(g)
O2(g) ![]() 8CO2(g)+9H2O(l);ΔH=+5 518 kJ· mol-1??
8CO2(g)+9H2O(l);ΔH=+5 518 kJ· mol-1??
D.C8H18(l)+ ![]() O2(g)
O2(g) ![]() 8CO2(g)+9H2O(l);ΔH=-48.40 kJ· mol-1???
8CO2(g)+9H2O(l);ΔH=-48.40 kJ· mol-1???
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
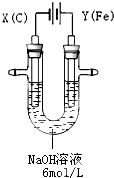 高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.
高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂.电解法制备高铁酸钾操作简便,成功率高,易于实验室制备.其原理如图所示.| 充电 | 放电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(H+)c(HCO-3) |
| c(H2CO3) |
| c(H+)c(HCO-3) |
| c(H2CO3) |
| 难溶电解质 | AgI | AgOH | Ag2S | PbI2 | Pb(OH)2 | PbS |
| KSP | 8.3×10-17 | 5.6×10-8 | 6.3×10-50 | 7.1×10-9 | 1.2×10-15 | 3.4×10-28 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com